
27.(3分)将A物质投入密闭容器中进行以下反应:2A(g) 3B(g)+C(g),在一定条件下达到平衡后,若A的分解率为50%,则平衡混合气体中A、B、C的体积之比为______________(不用写计算步骤)
3B(g)+C(g),在一定条件下达到平衡后,若A的分解率为50%,则平衡混合气体中A、B、C的体积之比为______________(不用写计算步骤)
26.(7分)已知在763K 3.04×104KPa时,用CO和H2为原料合成甲醇CH3OH,存在下列平衡:CO(g)+2H2(g) CH3OH(g),当原料中CO和H2的比例不同时,对CO的转化率及平衡混合气体中甲醇的体积分数都有影响,完成下列各题。
CH3OH(g),当原料中CO和H2的比例不同时,对CO的转化率及平衡混合气体中甲醇的体积分数都有影响,完成下列各题。
(1)设H2和CO的起始物质的量之比为m,平衡时CO的转化率为a,平衡混合物中甲醇的体积分数为y,试推断y、a、m三者的相互关系,并用y=f(a·m)的函数表达式表示出来_________________
(2)将表中的已知数据代入表达式中,把计算结果填入空格中
|
m |
a |
y |
|
1 |
0.25 |
|
|
2 |
0.45 |
|
|
3 |
|
19.35% |
(3)根据表中韵数据,判断用CO和H2合成甲醇时,的最焦体积比是少?______________ 并简述其依据: ________________________________________________。
25.(11分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与烧碱反应制得白色纯净的Fe(OH)2沉淀,有人设计了用电解法制备纯净的Fe(OH)2的方案,根据你所学的知识回答下列问题:(已知,两电极的材料分别为石墨和铁)
(1)电极材料的选择,阳极:_________________、阴极:____________________
电极反应式:(假若用NaOH溶液做电解质溶液)
阳极:__________________________、阴极:______________________________
(2)电解液的选择,可以是(填编号)_____________
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)做该实验时,最好在电解质溶液上覆盖一层苯,其作用为_______________________
在加苯之前, 对溶液做如何简单处理?_________________________________________
其目的是_________________________________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是______________
A.改用稀硫酸做电解液 B.适当增大电源的电压
C.适当减小两电极的距离 D.适当降低电解液的浓度
24.(6分)如有图所示,试管中放一根铁钉,铁钉浸入某电解质溶液中,数天后观察,根据观察到的不同现象回答下列问题:

(1)导管中液柱左边下降,右边上升。则试管中的电解质溶液的性质为______________发生的电极反应式为:
正极:_________________________、负极:________________________
(2)导管中液柱右边下降,左边上升。则试管中的电解质溶液的性质为______________发生的电极反应式为:
正极:__________________________、负极:_______________________
23.(9分)下图是一个原电池与电解池同时工作的例子,在其装置图标明电极的电子的流向。

写出四个电极的电极反应式及各级反应的氧化反应、还原反应类型
|
电极名称 |
电极反应式 |
电极反应类型 |
|
||
|
正极 |
|
|
|
||
|
负极 |
|
|
|
||
|
阳极 |
|
|
|||
|
阴极 |
|
|
|
||
22.(4分)某温度时,在2L的容器中X、Y、Z三种气体的物质的量随着时间的变化曲线如下图所示,下图中数据分析完成下列问题:

(1)由图中的数据分析该反应的化学方程式为___________________________
(2)前两分钟内,Z的平均反应速率为__________________________________
21.(4分)阿波罗号宇宙飞船上的氢氧燃烧电池,该电池的总反应式为2H2+O2=2H2O,电解质溶液为KOH溶液。
(1)此电池突出的优点是:把_________能直接转化为_________能,而不经过其它形式能的转化,从环境保护角度来说,还有_____________________。
(2)有关氢氧燃烧电池的叙述正确的是____________
A.此电池能够发出蓝色的火焰
B.氢气为正极、氧气为负极
C.工作时,电解质溶液的PH不断增大
D.两个电极的反应式:正极:O2+2H2O+4e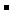 ==4OH
==4OH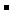
负极:2H2+4OH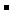 -4e
-4e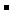 ==4H2O
==4H2O
20.体积相同的甲、乙两个容器,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡,该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 ( )
2SO3(g),并达到平衡,该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 ( )
A.等于P% B.大于P% C.小于P% D.无法判断
第Ⅱ卷 (非选择题 共50分)
19.可逆反应:3X(g) 3Y(?)+Z(?) △H>0随温度的升高,气体的平均相对分子质量有减小的趋势,则下列判断正确的是 ( )
3Y(?)+Z(?) △H>0随温度的升高,气体的平均相对分子质量有减小的趋势,则下列判断正确的是 ( )
A.Y和Z可能都是固体 B.若Z为固体,则Y一定是气体
C.Y和Z一定都是气体 D.Y和Z可能都是气体
18.反应:L(s)+aG(g) bR(g),达到平衡时温度和压强对该反应的影响如下图所示,图中P1>P2,
bR(g),达到平衡时温度和压强对该反应的影响如下图所示,图中P1>P2,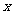 轴表示温度、
轴表示温度、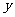 轴表示混合气体中G的体积分数,据此判断 ( )
轴表示混合气体中G的体积分数,据此判断 ( )

A.上述反应是放热反应 B.a>b
C.上述反应是吸热反应 D.a<b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com