
3.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰时体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
2.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。如图所示为该化合物晶体的结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为

A.MgB B.MgB2 C.Mg2B D.Mg3B2
1.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC单体可由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红,则为PE
D.等质量的聚乙烯和乙烯燃烧消耗的氧气相等
25.(10分)某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、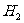 的燃烧热如下:
的燃烧热如下:
|
物质 |
田 |
乙 |
CO |
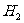 |
燃烧热/( ) ) |
1366 |
5518 |
283 |
286 |
取甲、乙按不同比例混合的燃油23g,在足量的 中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:

(1)乙的相对分子质量Mr(乙) ;
(2)160g由甲、乙等物质的量混合而成的燃油在347.2L 中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合
中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合
物中C、H、O的原子个数比为 ,甲、乙的分子式为:甲 ;乙
(3)1mol由甲、乙等物质的量混合而成的燃油在一定量的 中燃烧,放出热量2876
中燃烧,放出热量2876 ,则反应中生成CO为 mol。
,则反应中生成CO为 mol。
24.(8分)白色粉末A由 、
、 、
、 、
、 、NaCl等物质中的三种混合而成。取一定量A样品投入l00mL 2.2mol/L盐酸中,充分反应后过滤,最终得到100mL,pH=0的溶液,将此溶液蒸干,只得到8.19g纯净的B。
、NaCl等物质中的三种混合而成。取一定量A样品投入l00mL 2.2mol/L盐酸中,充分反应后过滤,最终得到100mL,pH=0的溶液,将此溶液蒸干,只得到8.19g纯净的B。
(1)B的化学式为 。
(2)通过计算推断A中是否含有NaCl。
(3)若反应中还生成V L(标准状况)气体,且该气体不会使品红溶液褪色,则取出的A样品中肯定含有 的物质的量是多少?(用含V的代数式表示)。
的物质的量是多少?(用含V的代数式表示)。
(4)A中各组成的物质的量之比不同时,所产生的沉淀物的量也不同,上述样品与盐酸反应可生成的沉淀的质量的最大值为多少?
23.(10分)酚是重要的化学原料,通过下图所示流程可合成阿司匹林、香料和一些高分子化合物。

已知:
(1)写出C的结构简式:
(2)写出反应②的化学方程式:
(3)写出G的结构简式;
(4)写出反应⑧的化学方程式;
(5)写出反应类型:④ ,⑦ 。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是 。
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液
22.(8分)lmol仅含C、H、O三种元素的有机物A,在稀硫酸中水解生成lmol B和lmolC。B分子中N(C):N(H)==4:5,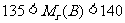 ;C与B分子中C原子数相同,且
;C与B分子中C原子数相同,且
(1)C的分子式为 ,A的摩尔质量为 。
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式: 。
(3)C有多种同分异构体,其中属于酯类的同分异构体有 种。
(4)C分子中苯环上有两个取代基,且苯环上的一氯取代物有两种。写出A的结构简式: 。
21.(10分)2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨。某校研究性学习小组拟对本市空气中二氧化硫含量( )进行测定。经查阅资料可采用以下方法:
)进行测定。经查阅资料可采用以下方法:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫,与副玫瑰苯胺、甲醛作用,生成紫红色化合物。据其颜色深浅,用分光光度计在577nm处进行测定。
分光光度计是利用分光光度法对物质进行定量、定性分析的仪器。而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单地用公式表示为 ,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。
,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。

实验步骤:
(1)采样:
①若你是该兴趣小组成员,你对采样的地点和时间有何建议:
②用图装置采样。通过50L空气后,将吸收液移入100mL容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不用导管的原因是
(2)吸光度与 含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25
含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25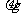 二氧化硫的标准液配置下表中的标准
二氧化硫的标准液配置下表中的标准 含量系列。
含量系列。
二氧化硫标准系列
|
管号 |
0 |
1 |
2 |
3 |
4 |
b |
|
标准液/mL |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
|
吸收液/mL |
10.00 |
9.80 |
9.60 |
9.40 |
9.20 |
9.00 |
二氧化硫含量/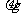 |
0 |
5.00 |
10.00 |
15.00 |
20.00 |
25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
|
管 号 |
0 |
1 |
2 |
3 |
4 |
5 |
|
吸光度 |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
以吸光度值为纵坐标,二氧化硫含量( )为横坐标,绘制标准曲线。
)为横坐标,绘制标准曲线。
(3)准确量取容量瓶中溶液10mL加人比色皿,测得其吸光度值为0.24,则空气中二氧化硫含量为  。我国环境空气质量标准中对每次空气质量测定中
。我国环境空气质量标准中对每次空气质量测定中 的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
(4)甲、乙两组同学测定结果相差较大,试分析乙组同学测定空气中 含量偏小的可能原因:(两个所用药品和装置均无问题)
含量偏小的可能原因:(两个所用药品和装置均无问题)
(5)请你提出江苏防治酸雨的两条主要措施:
20.(10分)A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质存在如图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题:

(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是 ;B的电子式是 ,A与甲反应的化学方程式是
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙常见金属,甲、乙、丙中只有甲是由短周期元素组成,乙与甲同主族,与丙同周期,乙也有强氧化性,且反应都在溶液中、通常条件下进行,则:
①A与乙反应的离子方程式为:
②C与丙反应的离子方程式为: 。
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为: 。
19.(8分)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加一对共用电子。试回答下列问题:
(1)分子式为 的烃分子中碳碳问共用电子对总数为 。
的烃分子中碳碳问共用电子对总数为 。
(2)分子式为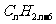 。的烃分子中碳碳问共用电子对总数为 。
。的烃分子中碳碳问共用电子对总数为 。
(3)若某物质分子中碳碳间的共用电子对总数为160,则符合该条件的碳单质( 可看作是烃减氢后的产物)的分子式为 ,符合该条件的单烯烃的分子式为
可看作是烃减氢后的产物)的分子式为 ,符合该条件的单烯烃的分子式为
(4)目前,化学家们已经找到十余种富勒烯家族的 ,它们的分子结构是由正五边形和正六边形构成的封闭凸多面体,
,它们的分子结构是由正五边形和正六边形构成的封闭凸多面体, 就是其中的一种富勒烯,其结构见图.第(3)小题中的
就是其中的一种富勒烯,其结构见图.第(3)小题中的 也是其中一种富勒烯。则第(3)题中
也是其中一种富勒烯。则第(3)题中 结构中五边形和六边形的个数分别是
和
结构中五边形和六边形的个数分别是
和

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com