
8.反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)可表示为 ( )
(X)可表示为 ( )
A. (NH3)=0.010mol·L-1·s-1 B.
(NH3)=0.010mol·L-1·s-1 B. (O2)=0.0010mol·L-1·s-1
(O2)=0.0010mol·L-1·s-1
C. (NO)=0.0010mol·L-1·s-1 D.
(NO)=0.0010mol·L-1·s-1 D. (H2O)=0.045mol·L-1·s-1
(H2O)=0.045mol·L-1·s-1
7.高铁电池是一种新型可充电电池,其总反应为
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列有关叙述错误的是 ( )
A.放电时,每转移3mol电子有1molK2FeO4被氧化
B.放电时,正极附近溶液碱性增强
C.充电时,阴极反应为Zn(OH)2+2e-→Zn+2OH-
D.充电时,阴极附近溶液碱性减弱
6.下列关于pH变化的判断正确的是 ( )
A.随着温度的长高,Na2CO3溶液pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,溶液pH减小
D.氢氧化钠溶液久置于空气中,溶液pH变大
5.在一定条件下,固定容积的密闭容器中反应:2NO2(g) 2NO(g)+O2(g),△H >0达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 ( )
2NO(g)+O2(g),△H >0达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 ( )

A.X表示温度时,Y表示NO2物质的量
B.X表示压强时,Y表示NO2的含量
C.X表示反应时间时,Y表示混合气体的密度
D.X表示NO2物质的量,Y表示O2的物质的量
4.已知25℃101kPa下,石墨和金刚石燃烧的热化学方程式如下
C(石墨)+O2(g) CO2(g); △H=-393.51kJ·mol-1
C(金刚石)+O2(g) CO2(g); △H=-395.41kJ·mol-1
下列关于C(石墨) C(金刚石)的焓变△H及有关叙述正确的是 ( )
A.△H >0;等质量时石墨能量比金刚石低
B.△H >0;等质量时石墨能量比金刚石高
C.△H <0;等质量时石墨能量比金刚石低
D.△H <0;等质量时石墨能量比金刚石高
3.一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下,为减慢反应的速率而又不影响氢气的量,可向其中加入 ( )
A.KCl固体 B.铁粉 C.K2SO4溶液 D.KNO3溶液
2.在理论上不能用于设计原电池的化学反应是 ( )
A.Al(OH)3(s)+NaOH(aq) NaAl(OH)4(aq);△H<0
B.CH3CH2OH(l)+3O2(g)→2CO2(g)+3H2O(l); △H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3; △H<0
D.H2(g)+Cl2(g) 2HCl(g); △H<0
1.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.钢铁电化腐蚀时,负极反应为:Fe Fe2++2e-
Fe2++2e-
B.AlCl3水解的离子方程式:Al3++3H2O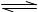 Al(OH)3+3H+
Al(OH)3+3H+
C.NaOH(aq)与NaHCO3(aq)反应离子方程式:HCO3-+OH- CO32-+H2O
D.氢气燃烧的热化学方程式为2H2(g)+O2(g)
2H2O(g);
△H=571.6kJ·mol-1
25.(10分):中学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如图所示:

①写出 、
、 和
和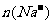 的关系:
的关系: =
。
=
。
②设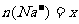 mol、
mol、 mol,请填写下表:
mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca(OH)2 |
NaOH、 Ca(OH)2 |
NaOH、Ca(OH)2、 H2O |
|
n(Na+)和 n(Ca2+)的关系 |
 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.60g,剩余固体在580℃C继续加热至恒重,固体质量又减少了0.70g。请通过计算确定该碱石灰各成分的质量分数。
24.(8分)丁烷在一定条件下可以按两种方式裂化:C4H10→C2H6+C2H4,C4H10→CH4+C3H6。现对发生裂化反应后的裂化气(不含丁烷)进行研究。
(1)探究裂化气的热值。已知:
|
气体 |
CH4 |
C2H6 |
C2H4 |
C3H6 |
|
燃烧热/(kJ/mol) |
Q1 |
Q2 |
Q3 |
Q4 |
①若44.8L(标准状况)裂化气充分燃烧放出热量Q kJ,则Q的取值范围介于: -
(用Q1、Q2、Q3、Q4表示,下同)。
②若将44.8L气体缓缓通过盛有足量溴的四氯化碳溶液中,发现洗气瓶增重33.6g,则44.8L(标准状况)气体完全燃烧放出的热量Q= kJ.
(2)测量与H2加成反应后气体总体积与氢气的体积分数的关系。
另取裂化气与H2混合得5L混合气体,已知其中H2的体积分数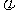 (H2)
(H2) ,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与
,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与 的函数关系式。
的函数关系式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com