
11.某离子晶体的晶体结构中最小重复单元如下图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为 ( )

A.B2A B.BA2 C.B7A4 D.B4A7
10.常温下,下列溶液中可能大量共存的离子组是 ( )
A.水电离产生的c(H+)=1×10-12mol·L―1的溶液:Mg2+、SO42―、NO3―、Cl―
B.含有大量Fe3+的溶液:K+、Na+、AlO2―、SO42―
|
D.含有大量S2-的溶液:Na+、ClO―、Cl―、CO32―
9.由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是 ( )
A.水分子的化学性质改变 B.水分子中氢氧键缩短
C.水分子间的作用力减小 D.水分子间结构、物理性质改变
8.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.18 g冰中最多含有氢键的数目为4 NA
B.0.1L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA
C.7.8 g Na2O2中阴、阳离子总数为0.4 NA
D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 NA
7.下列有关比较中,大小顺序排列错误的是 ( )
A.沸点:NH3>H2O>HF>HCl
B.物质的熔点:石英>食盐>碘>汞
C.结合质子(H+)的能力:OH->NH3>H2O
D.粒子的直径:S2->Cl->K+>Ca2+
6.下列物质中,属于含有极性键的离子晶体的是 ( ) A.CH3COOH B.Na2O2 C.NaOH D.MgCl2
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是_______________________
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:__________________________________。
17.(10分)A、B、C均为钠的常见化合物,在空气中露置均易变质,且A的变质过程中伴有明显的颜色变化。已知C是一种消毒剂的有效成分,D、F为常见单质气体,E为主要的大气污染物之一,H溶液显强酸性,N溶液中的阴离子与H溶液中的相同。它们可以发生如图所示的反应。
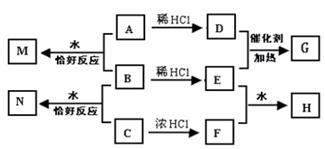
完成下列各题:
(1)检验A在空气中完全变质的实验操作和现象为 _____________________
(2)B在空气中变质的化学方程式为 _________________________。
(3)B与C在水中反应的离子方程式为 _________________________,若有1molC参加反应,电子转移为 NA(NA为阿伏加德罗常数)。
(4)鉴定H中两种阴离子的实验方案______________________________________。
18.(12分)海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
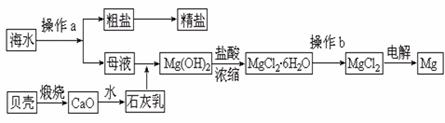
回答下列问题:
(1)流程图中操作a的名称为 。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是_______________________________________________________________
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
______________________________________________________________________
②操作b是在 气氛中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式
___________________________________________________________________。
19.(10分)下图表示各物质之间的转化关系。已知:A、D、F、H 均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:
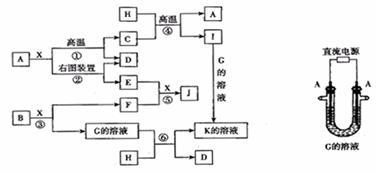
(1)写出生成E的电极反应式____________________________________________
反应⑤的现象是_____________________________________
(2)反应①的化学方程式是 ,在实验室中引发反应④的操作是 。
(3)反应⑥的离子方程式是 。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Ag 108
1.分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.依据有否电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.依据能量的变化,将化学反应分为放热反应和吸热反应
D.依据组成元素的种类,将纯净物分为单质和化合物
2.化学与生活密切相关,下列有关说法正确的是 ( )
A.目前加碘食盐中主要添加的是KI
B.生理盐水的浓度为0.9%
C.淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物
D.家庭可以用明矾将自来水净化成纯净水
3.氮化硅陶瓷是一种超硬耐磨物质,可用于制造高性能柴油机发动机部件,它属于( )
A.有机合成材料 B.复合材料 C.无机非金属材料 D.金属材料
4.下列说法不正确的是( )
A.所有的复分解反应都是非氧化还原反应
B.液氨、液氯、液态氯化氢都是非电解质
C.静电除尘利用了胶体能发生电泳的性质
D.使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定
5.下列离子方程式中正确的是( )
A.铜与稀硝酸反应:Cu+2H++NO3-=Cu2++NO↑+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
C.过量的二氧化碳通入漂白粉溶液中:ClO-+CO2+H2O=HClO+HCO3-
D.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
6.根据元素周期表知识,下列说法不正确的是( )
A.最外层电子数为3~7的原子一定是主族元素的原子
B.短周期元素X、Y,若X、Y的最外层电子数相同,且X原子半径小于Y,当X (OH)n为强碱时,Y(OH)n必为强碱
C.短周期元素A、B,若A、B电子层数相同,且A原子半径小于B,当HnAOm为强酸时,B必为活泼非金属元素
D.2007年3月21日,中国科学技术名词审定委员会公布了111号元素Rg的中文名称,111号元素属于过渡元素
7.下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是


|
编号 |
气体 |
a |
b |
c |
|
A |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
B |
CO2 |
盐酸 |
碳酸钙 |
饱和NaHCO3 |
|
C |
NO |
稀HNO3 |
铜屑 |
H2O |
|
D |
NO2 |
浓HNO3 |
铜屑 |
NaOH溶液 |
8.以下物质的制备原理不正确的是( )
A.无水氯化镁的制备:MgCl2·H2O MgCl2+6H2O
MgCl2+6H2O
B.钴的制备:3Co3O4+8Al 9Co+4Al2O3
9Co+4Al2O3
C.烧碱的制备:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
D.漂粉精的制备:2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O
|
3Fe3++2S2O32-+O2+xOH- Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
A.1molFe3+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
B.x=4
C.每生成1molFe3O4,反应转移的电子总数为4mol
D.S4O62-是还原剂
10.一定能在指定环境中大量共存的是( ) A.c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
B.在由水电离出的c(H+) = 1×10-12mol/L的溶液中:Fe 3+、ClO-、 Na + 、SO42-
C.在pH=1的溶液中:NO3-、SO42-、Na+ 、 Fe 2+
D.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
11.若用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.32g臭氧中,含有氧原子2NA
B.在标准状况下,2.24L苯中所含分子数约为NA
C.9gD2O中含有的电子数为5NA
D.7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
12.某溶液含有III中的离子(见下表),欲用I中的试剂来检验溶液是否还含有II中的离子,能够进行成功检验的是(说明:在实验过程中不允许加热、过滤、萃取等操作)( )
|
选项 |
I |
II |
III |
|
A |
稀氨水 |
Al3+ |
Mg2+ |
|
B |
稀硝酸、AgNO3溶液 |
Cl- |
I- |
|
C |
KSCN溶液 |
Fe2+ |
Fe3+ |
|
D |
稀盐酸、BaCl2溶液 |
SO42- |
SO32- |
13.取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于( )
A.8.64g B.9.20g C.9.00g D.9.44g
14.短周期元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。下列说法不正确的是( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的溶液能使酚酞试液变红
B.C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A-E的顺序依次增大
第Ⅱ卷(非选择题 共58分)
15.(9分)某兴趣小组同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
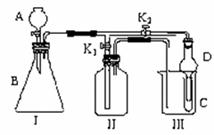
(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1关闭K2,可制取 气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是__________________________________________________;打开K2关闭K1,将A中液体加入B中后,观察到的实验现象为___________________________________。
16.(17分)某品牌消毒液包装说明的部分内容摘录如下:主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com