
25.(5分)为探究CO2与NaOH溶液发生了化学反应,甲、乙两位同学设计了下列两种实验装置,请回答下列问题。
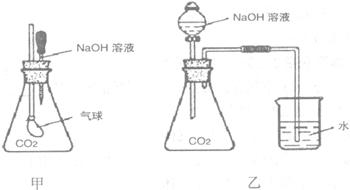
(1)请写出过量CO2与少量的NaOH发生反应的离子方程式:__________________。
(2)简述上述会出现的实验现象,解释产生该实验现象的原因。
甲:
乙:
24.(10分)
(1)下列有关实验操作或判断正确的是_________(填有关序号,选错倒扣分)。
A.用溴水可以除去乙烯中混有的二氧化硫气体。
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出。
C.用托盘天平称取10.50g的干燥的NaCl固体。
D.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液。
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌。
F.实验室配制氯化Ⅱ铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
G.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
H.往溶液中加入用盐酸酸化的氯化钡溶液鉴定硫酸根离子。
I.新制氢氧化铜浊液(与醛反应):在试管中加2mL5%NaOH溶液,滴加CuSO4溶液4-5滴。
(2)下列制取干燥氨气和氯气的装置中,有错误的是_________(填仪器序号),应如何改正______________________________________________________。
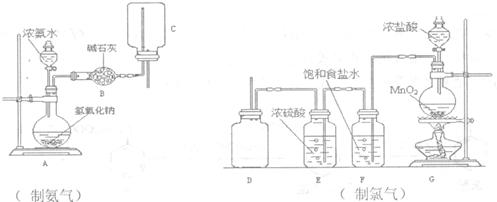
在制氨气装置中,碱石灰的作用____________________________________。
G中反应的化学方程式为__________________________________________。
23.(5分)
(1)目前,世界上已将乙烯的产量作为衡量一个国家石油化工发展水平的标志。乙烯的结构式为____________。
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X的结构简式是____________。
(3)某有机物分子式为C3H6O2在酸性条件下水解得一元酸A与一元醇B,A与B的相对分子质量相等,则A的结构简式为____________。
(4)食品香精菠萝酯的生产路线(反应条件略去)如下:
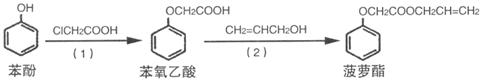
下列叙述错误的是__________
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
E.(1)的反应类型为加成反应
22.(10分)根据下列转化关系,回答有关问题。

(1)淡绿色溶液D主要成分的化学式为___________,试剂1的化学式是___________;
(2)下列物质不能作为试剂2的是____________。
a.Cl2 b.新制氯水 c.浓硫酸 d.S e.硝酸
(3)固体A溶于稀盐酸的化学方程式为____________________________________。
(4)溶液C到溶液F红色加深的原因是:____________________________________。
(5)某同学在实验时向E中加入了过量的一种固体物质,发现淡黄色褪去,现对褪色原因进行探究。
提出你的假设:________________________________________________;
为了对你所提出的假设进行验证,你设计的实验方案是_____________________。
21.(6分)元素周期表揭示了许多元素的相似性和递变规律,根据元素周期表元素的性质和递变规律,回答下列问题。
(1)1-20号元素中金属性最强的元素与水反应生成的化合物为____________。
(2)写出电子数为18的四种不同形式的微粒(原子、离子、同原子分子、化合物各一种)________________________。
(3)写出原子序数为16的元素阴离子的核外电子排布示意图____________。
20.为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[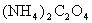 ]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5mol/LKMnO4溶液滴定(生成Mn2+、CO2、H2O),恰好消耗1.6mL,则该病人血液中含钙量为
]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5mol/LKMnO4溶液滴定(生成Mn2+、CO2、H2O),恰好消耗1.6mL,则该病人血液中含钙量为
A.8 g/L B.2.4 g/L C.6 g/L D.12 g/L
第Ⅱ卷(非选择题 共50分)
19.设NA表示阿伏加德罗常数,下列说法正确的是
A.1L 1mol·L-1的盐酸中,所含氯化氢分子数为NA
B.标准状况下,2.24L苯中含有的分子数为0.1NA
C.0.1mol 原子中含质子数为NA
原子中含质子数为NA
D.常温常压下,16g臭氧含有氧原子的数目为NA
18.下图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入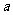 g M和
g M和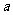 g N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法不正确的是
g N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法不正确的是
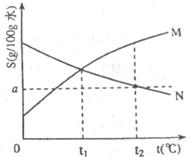
A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到N的饱和溶液、M的不饱和溶液
C.t1℃时,M、N的溶质质量分数一定相等
D.t2℃时,M、N的物质的量浓度不一定相等
17.三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为: ;
; ,下列说法不正确的是
,下列说法不正确的是
A.HNCO是一种很强的氧化剂
B.C3N3(OH)3与HNCO为两种不同的物质
C.1mol NO2在反应中转移的电子为4mol
D.反应中N2是还原产物
16.下列有关铁及其化合物的说法中不正确的是
A.分别还原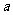 mol Fe2O3所需H2、Al、CO物质的量之比为3︰2︰3
mol Fe2O3所需H2、Al、CO物质的量之比为3︰2︰3
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁质容器储存、运输浓硝酸、浓硫酸
D.检验某物体是否含Fe2O3的操作步骤为:样品→粉碎→加热→溶解→过滤→向滤液中滴加KSCN溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com