
18.(12分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计如图所示实验来定性检验茶叶中含有Ca、Al、Fe三种元素。

[查阅部分资料]草酸铵[(NH4)2C2O4]属于弱电解质;Ca、Al、Fe完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1)
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是 。
(2)写出检验Ca2+的离子方程式: 。
(3)写出沉淀C所含主要物质的化学式: 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,猜测步骤⑩的目的是 。
17.(10分)(1)实验室利用图所示装置来测定KClO3和KCl混合粉末中KClO3的含量。回答下列问题:

①若读数时俯视液面,则测得的实验结果 (选填“偏大”、“偏小”或“无误差”,②同);
②若未待气体恢复至室温时读数,则测得的实验结果 ;
③在操作完全正确的前提下,测得的实验结果仍可能偏小,原因是 。
(2)下图是实验室制取和收集氨气的装置图。回答下列问题:
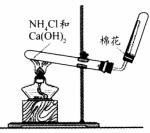
①装置中棉花的作用是 ;
②适当改变图所示的装置后,也可用来制取和收集氧气。改变的方法是 ;
③实验室用浓硫酸和铜制取并收集少量的SO2气体,能否采用该装置? (选填“能”或“不能”),若选填“能”,请说明你的理由;若选填“不能”,则怎样改变该装置后就能达到实验目的?请你用文字说明 。
16.如图,I是恒压密闭容器,Ⅱ是恒容密闭容器。其他条件相同时,在I、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)
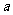 Z(g)。此时工中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
Z(g)。此时工中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是

A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于V L
15.A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属。D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是
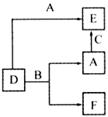
A.D、E中一定都含有A的元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
14.下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是

A.电池充电时阳极电极反应式为:3Br -2e
-2e =Br
=Br
B.电池放电时,负极电极反应式为:2S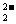 +2e
+2e =S
=S
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr==2Na2S2+NaBr3
D.在充电过程中Na+通过膜的流向为从左到右
13.下列离子方程式不正确的是
A.用NaOH溶液吸收足量H2S气体:OH +H2S==HS
+H2S==HS +H2O
+H2O
B.NH4HCO3溶液中加入足量NaOH溶液:NH +OH
+OH ==NH3·H2O
==NH3·H2O
C.标准状况下112mL Cl2缓慢通入1mol/L FeBr2溶液10mL:
2Fe2++4Br +3Cl2==2Fe3++2Br2+6Cl
+3Cl2==2Fe3++2Br2+6Cl
D.CaCO3溶于CH3COOH:CaCO3+2CH3COOH==Ca2++2CH3COO +H2O+CO2 ↑
+H2O+CO2 ↑
12.Cl2、SO2均能使品红溶液褪色。后者因为品红分子结构中的发色团遇到亚硫酸后结 构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
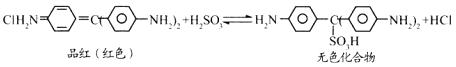
下列说法正确的是
A.品红溶液中同时通入Cl2、SO2,漂白效果会更好
B.加热可判断品红褪色是通入SO2还是通入Cl2引起的
C.“无色化合物”分子中,19个碳原子都可能在同一平面上
D.品红分子结构中,19个碳原子都可能在同一平面上
11.在100g浓度为18mol/L、密度为 g/cm3的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
g/cm3的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
A.大于100mL B.小于100mL C.等于100mL D.等于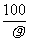 mL
mL
10.室温下,某无色透明溶液中由水电离出来的H+和OH 浓度的乘积为1×10
浓度的乘积为1×10 ,则此溶液中可能大量共存的离子组为
,则此溶液中可能大量共存的离子组为
A.HCO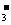 、Al3+、Na+、SO
、Al3+、Na+、SO B.I
B.I 、NO
、NO 、K+、NH
、K+、NH
C.MnO 、Cl
、Cl 、SO
、SO 、K+ D.SiO
、K+ D.SiO 、SO
、SO 、Na+、Cl
、Na+、Cl
9.下列叙述正确的是
A.微粒间以分子间作用力结合的晶体,其熔点不会很高
B.正四面体构型的分子中,键角一定为109°28′
C.离子晶体中含有离子键,也可能含有共价键
D.金属阳离子只能与阴离子构成晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com