
4.下列有关物质类别判别的依据中,正确的是
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.酸性氧化物:能否与碱反应
3.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的P的一种同位素-30P,开创了人造核素的先河:27Al + 4He → 30P + 1n下列有关说法不正确的是
A.该变化说明原子核在化学反应中也能发生变化
B.该变化同样遵循质量守恒定律
C.1n是一种电中性粒子
D.30P中:质子数=中子数
2.下列化学用语表达正确的是
A.丙烷的分子结构模型示意图: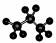
B.Na2S的电子式:
C.Na原子的电子排布式:1s22s22p6
D.氢硫酸的电离方程式:H2S = 2H+ + S2-
1.2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的贡献。物质接触表面发生的化学反应对工业生产运作至关重要。同时,表面化学研究有助于我们理解各种不同的过程。以下事实或现象与表面化学无密切关系的是
A.熔化的铝不易滴落下来
B.利用铁的表面作为催化剂用氮气和氢气合成氨
C.常温下,可以用铁、铝的容器来盛装冷的浓硫酸
D.CuSO4溶液中加入BaCl2溶液时产生白色沉淀
23.(8分)往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:

(1)A点时,白色固体M的化学式为__________________,通入的CO2的体积为__________mL。(标准状况下,下同。)
(2)C点时,白色固体M的化学式为__________________,通入的CO2的体积为__________mL。
(3)B点时M的组成成分为__________________,通入的CO2的体积为__________mL。
(4)该NaOH溶液的物质的量浓度为___________。
22.(8分)下图中的每一个方格表示有关的一种反应物或生成物。已知X为一种盐,其分解产物中A、B、C的物质的量之比为1︰1︰1,A为无色无味气体。试完成下列问题:

(1)写出下列物质的化学式:X__________,F__________。
(2)写出下列反应的化学方程式
反应①________________________________________;
反应②________________________________________;
反应③________________________________________。
21.(13分)某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式______________________________。
(2)装置A中烧瓶内固体可以选用__________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅
D.五氧化二磷 E.烧碱 F.氢氧化钠和氯化铵的混合物
(3)上图A-F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。
(4)氯气和氨气在常温下混合就会反应生成氯化铵和氮气,写出反应的化学方程式______________________________。装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案检验其中的 :______________________________。
:______________________________。
(5)若从装置C的G处逸出的尾气只含有N2和少量Cl2,应如何处理才能不污染环境?
20.(8分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品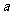 g,所用称量仪器使用的第一步操作为____________________。
g,所用称量仪器使用的第一步操作为____________________。
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有____________________。
(3)在滤液中加过量NaOH溶液,过滤。
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止。冷却后称量,质量为 g。有关反应的离子方程式为____________________________,该样品中铝的质量分数为_________。
g。有关反应的离子方程式为____________________________,该样品中铝的质量分数为_________。
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果__________(填“偏高”、“偏低”或“不影响”,下同)。
②若步骤(4)中沉淀没有洗涤,则能使测定结果__________。
19.(9分)A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则:
(1)B的原子结构示意图__________;
(2)B、C、E与A形成的化合物中最稳定的是__________(写化学式);
(3)C与D形成的化合物的化学式是__________,它的性质决定了它在物质的分类中应属于__________;请写出该化合物的水化物的电离方程式:_________________。
(4)F的单质在反应中常作__________剂,该单质的水溶液与E的低价氧化物反应的离子方程式为__________________________________________________。
18.(8分)
(1)一定温度下,把相对分子质量为M的可溶性盐Wg溶解在VmL水中,恰好形成饱和溶液(密度为 ),则溶质的质量分数为___________,物质的量浓度为___________,该温度下此盐的溶解度为___________。
),则溶质的质量分数为___________,物质的量浓度为___________,该温度下此盐的溶解度为___________。
(2)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要仪器的名称为_________________________________。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用60mL,2mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为_____________,该同学将精盐放在天平的右盘中称量好后,配制成溶液,则该溶液的浓度__________
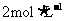 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com