
6.在含有大量Ba2+和 的溶液中,能大量共存的离子组是 ( )
的溶液中,能大量共存的离子组是 ( )
A.H+ K+ ClO- Cl- B.H+ NH4+ Fe2+ Br-
C.NH4+
K+ Cl-  D.K+ Na+ Cl- OH-
D.K+ Na+ Cl- OH-
5.下列离子方程式书写正确的是 ( )
A.AgNO3溶液中加入过量氨水:Ag++NH3H2O===AgOH↓+NH4+
B.把0.4mol铁粉和0.8mol稀硝酸充分反应:Fe+4H++NO3-===Fe3++NO↑+2H2O
C.石灰水与Na2CO3溶液混合:Ca2++ ===CaCO3↓
===CaCO3↓
D.NH4HSO3溶液与足量NaOH溶液也混合:HSO3-+OH-====SO32-+ H2O
4.下述实验能达到预期目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
金属钠投入硫酸铜溶液中 |
置换出铜 |
|
B |
向硫酸铝溶液中滴加过量氨水 |
制取氢氧化铝 |
|
C |
将氯化铁溶液加热蒸发 |
制氯化铁晶体 |
|
D |
把铜和银用导线连接后插入稀硫酸中 |
组成原电池验证铜比银活泼 |
3.阿伏伽德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.2.24LCl2中含有的原子数一定为0.2×6.02×1023
B.0.1L2mol·L-1的Na2CO3溶液中含有CO32-数目为0.2×6.02×1023
C.0.88gC3H8中含有的共价键总数为0.2×6.02×1023
D.7.8g过氧化钠粉末与水反应转移的电子数为0.2×6.02×1023
2.下列药品保存方法正确的是 ( )
A.白磷保存在煤油中 B.在氯化亚铁试剂中加盐酸和铁粉
C.金属钾保存在CCl4中 D.过氧化钠保存配有玻璃塞的广口试剂瓶中
1.2008年的诺贝尔化学奖被三位科学家(见下图)共同获得,以表彰他们在“发现和研究绿色荧光蛋白(green fluorescent protein 简称GFP)方面做出的贡献”。GFP需要在氧化状态下产生荧光,强化还原剂能使GFP转变为非荧光形式,但一旦重新暴露在空气或氧气中,GFP荧光便立即得到恢复。下列说法不正确的是 ( )

A.GFP是有氨基酸构成的能发出荧光的一类特殊蛋白质
B.可用GFP标记需要研究的蛋白质,研究特定的反应
C.GFP的发光是将化学能转化为光能
D.GFP产生荧光不受外界环境影响
26.(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
① A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
② 在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③ 在C的溶液中加入铁粉,溶液的质量增加;
④ 在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、D 、E
(2)写出②、③、④的离子方程式:
②
③
④
25.(9分)把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
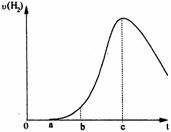
(1)曲线由0→a段不产生氢气的原因_________________;(用化学方程式表示)
(2)曲线由a→b段产生氢气的速率较慢的原因________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因__________________。
24.(13分)在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色(单质)物质是 (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________ (填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为__________
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 (填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验②产生的刺激性气味气体通入品红溶液,可以看到品红溶液______说明这种气体具有_____________________性;将②中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式________________________________
(5)能否用澄清石灰水鉴别这两种气体? (填“能”或“不能”)若不能请填写两种能鉴别的试剂 。
23.(10分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。

(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为:________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入Cl2的速度不同,
ClO-和ClO3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若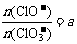 ,则n(Cl-)= mol(用含a的代数式来表示)。
,则n(Cl-)= mol(用含a的代数式来表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com