
12.根据下列事实得出的结论正确的是 ( )

11.“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是其重要举措之一。以下两种兴奋剂的结构分别为

则关于它们的说法中正确的是 ( )
A.它们遇FeC13溶液均显紫色,均为芳香族化合物
B.1mol利尿酸分别与H2和浓溴水反应时最多消耗H2和Br2分别为5mol、7mol
C.两种兴奋剂中滴入KMnO4(H+)溶液,观察紫色均会变浅
D.两种分子中的所有碳原子均不可能共平面
10.下列有关表述正确的是 ( )
A. 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高正化合价一定是X<Y
B. 分子晶体的熔沸点都很低,所以常温下都呈液态或气态
C. 热稳定性:AsH3<PH3<H2O<HF
D. 最外层电子数较少的金属元素,一定比最外层电子数较多的金属元素活泼性强
9.设NA为阿伏伽德罗常数,下列说法正确的是 ( )
A.已知异丁烷比正丁烷稳定,则正丁烷转化为异丁烷的过程为吸热过程
B.标准状况下,22.4LNO与11.2LO2混合所得气体的分子数一定小于NA
C.3.2gCu在硫蒸气中完全燃烧,转移的电子数为0.1NA
D.1molP4与1molSiO2晶体中所含有的共价键数目都为4NA
8. 短周期元素W、X、Y、Z,W元素的一种原子无中子,X与Z同主族、与Y同周期,Y是地壳中含量最丰富的元素,Z元素原子的最外层电子数是内层电子数的0.4倍,则下列有关叙述正确的是 ( )
A.XY2与ZY2的化学键类型和晶体类型相同
B.ZY2为酸性氧化物,可以与强碱反应,但不能与任何酸反应
C.XW4与XY2均为只含极性键的非极性分子
D.常温下Z的单质很稳定,既不与酸反应,也不与强碱反应
7.下列有关说法正确的是 ( )
A. 合成氨工业与接触法制硫酸中的SO2的催化氢化过程中都采用了高压的生产条件
B. 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
C. 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D. 氟利昂和NOX都能破坏臭氧层,从而导致“温室效应”
选择题(本题包括18小题,每小题6分,共108分,每小题只有一个选项符合题意)
6.生活是化学的源泉,下列有关生活中的化学叙述不正确的是 ( )
A.在采煤工业上,把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾
B.游泳池中可采用臭氧和活性炭来进行水的消毒和净化
C.大量使用含磷洗衣粉可导致水体富营养化
D.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
23、(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
22.(10分)有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:

第③个实验中,生成白色沉淀的量与加入NaOH的量有下图所示的相互关系。据此可知:

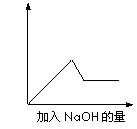

(1)在原溶液中一定不存在的离子有_____________________,
(2)为满足该溶液中一定存在的离子的要求,一般可溶解两种常见物质为(写化学式)___________和_________。
(3)写出第③个实验中发生反应的离子方程式
___________________________________________________________________。
21、(10分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而Zn(OH)2却溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的化学方程式 ;
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com