
29.(15分)曾发生数起液氯贮罐、钢瓶爆炸事故,其原因是液氯中混杂有三氯化氮(NCl3)。NCl3常温下是一种淡黄色液体,具有光敏性和爆炸性,当液氯中NCl3的质量分数(指NCl3的质量占氯气和NCl3的总质量的百分比)达到4%以上就有爆炸的危险。
(1)三氯化氮分子的结构呈 形,是 (填极性或非极性)分子。NCl3在湿气中易水解生成一种常见的漂白剂和一种碱性气体,请写出其水解的化学方程式: 。
(2)NCl3爆炸时生成N2和C12。已知24.1g NCl3发生上述反应时放出的热量为45.6KJ,请写出该反应的热化学方程式: 。
(3)氯气中三氯化氮含量的测定,对氯碱化工行业的安全生产具有重要意义。某氯碱厂为测氯气中三氯化氮的含量,将样品先用内盛10.0 mL盐酸试剂的吸收管吸收NCl3(NCl3+HCl→NH4Cl+C12,未配平),然后用内盛400 mL 20.0%(p=1.22g/cm3)工业氢氧化钠吸收瓶吸收氯气,碱吸收瓶吸收后质量增加51.4g三氯化氮吸收管内的氯化铵经仪器测定:其中NH 质量为0.270g。试求该样品中NCl3的质量分数,该样品是否安全?(请写出计算过程)
质量为0.270g。试求该样品中NCl3的质量分数,该样品是否安全?(请写出计算过程)
28.(16分)A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一。C的溶液能发生银镜反应,反应后的溶液经酸化可得D。G为单质,其原子最外层电子数为次外层的2倍。F中阴阳离子个数比为l:l,其阳离子与Ar具有相同的电子层结构(注:CuO与G反应生成B;E加热分解生成B和F;部分反应条件、反应物、生成物略去:A-F的转化关系如下图)。
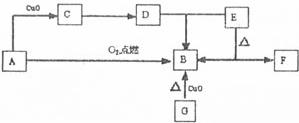
(1)D与E反应生成B的离子方程式 :
(2)单质G中的元素位于第 周期 族。G与F在高温下反应生成固体H和一种还原性气体,I可通过两步反应制得A。它们之间的转化关系如上图(部分反应条件、反应物、生成物略去)。
(3)H的电子式: I的结构式: 。
(4)写出由I制备A的两步反应的化学方程式:
(5)写出G与F在高温下反应生成固体H的化学反应方程式 。
27.(15分)有人设计了如下制备氢氧化亚铁的改进实验:
(I)按下图所示组装仪器;向一支小的具支试管中加入2mL左右稀盐酸,再加入2mL左右的煤油;玻璃管下端粘住钠粒(用滤纸吸干表面煤油,切去氧化层)。

(II)将铁丝浸入盐酸,反应放出氢气,待试管内空气排尽后,向上提拉铁丝,使铁丝脱离液面。并关闭弹簧夹;用另一根细铁丝沿玻璃管内将钠粒捣入液体中。
请回答下列问题:
(1)写出该实验中发生反应的化学方程式:
(2)如何检验试管内空气已排尽(回答具体操作)?
(3)捣入钠粒后,预测具支试管中的现象:
(4)已知钠粒的质量约0.05 g,现实验室有以下两种不同浓度的盐酸,你选择(填A或B)
A.1.1mol/L B.10 mol/L
26.(14分)A、B、C、D、E五种短周期元素,其中A、B、C处于相邻位置,且三种元素原子序数依次增大,原子序数之和是4l。D的原子序数介于A、B之间,D单质在空气中燃烧生成淡黄色固体。E的一种核素中无中子。
(1)元素符号:A 、B 、C 、D 、E 。
(2)写出制取A2的化学方程式: (反应物仅能利用题设的五种元素中的某几种)
(3)写出实验室制取C2的离子方程式:
(4)检验某溶液中含有BA 的方法是:
的方法是:
13.往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标况下)时立即停止,则在这一过程中,溶液中离子总的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计) ( )

非选择题共10大题,共174分
12.下列实验操作中,正确的是 ( )
A.蒸发溶液时,边加热边搅拌,直至蒸发皿内的液体蒸干
B.量取25.00mL KMnO4溶液时,应选择酸式滴定管
C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4注入容量瓶中加水稀释,边注入边搅拌
D.配制一定物质的量浓度的溶液时,若未洗涤烧杯和玻璃棒,则会导致所配溶液的物 质的量浓度偏高
11.有一无色溶液,可能含有K 、A1
、A1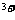 、Mg
、Mg 、NH
、NH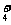 、C1
、C1 、SO
、SO 、HCO
、HCO 、MnO
、MnO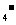 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产主。下列推断正确是( )
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产主。下列推断正确是( )
A.肯定有A1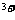 、Mg
、Mg 、NH
、NH 、C1
、C1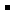 B.可能有K
B.可能有K 、C1
、C1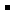 、MnO
、MnO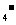
C.肯定有A1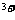 、Mg
、Mg 、SO
、SO D.肯定有K
D.肯定有K 、HCO
、HCO 、MnO
、MnO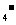
10.下列有关说法中正确的是( )
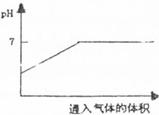
A.向氢硫酸的溶液中不断通入SO2气体,溶液的pH与通入SO2气体的体积之间的关系如下图:
B.在反应SiO2+3C SiC+2CO中氧化剂与还原剂的物质的量之比是l:3。
SiC+2CO中氧化剂与还原剂的物质的量之比是l:3。
C.在FeO与足量浓HNO3的反应中,浓HNO3既表现出氧化性又表现出酸性。
D.由反应SiO2+CaCO3 CaSiO3+CO2 ↑,可推知硅酸的酸性比碳酸的酸性强。
CaSiO3+CO2 ↑,可推知硅酸的酸性比碳酸的酸性强。
9.今年9月爆发了“毒奶粉”事件:国家质检总局检出22个厂家69批次产品中含有超标的三聚氰胺,被要求立即下架。三聚氰胺是一种用途广泛的基本有机化工中间产品,是一种毒性轻微的物质,但长期服用该物质后会引起肾衰竭。其结构式如下图:下列关于三聚氰胺的说法不正确的是 ( )

A.分子式为C3H9N6
B.三分子氨基腈(H2N-C≡N)通过加成反应可得三聚氰胺
C.不法之徒用于掺进牛奶,目的是增加牛奶中的含氮量,以增加“蛋白质”
D.已知二聚氰胺遇强酸或强碱水溶液水解,氨基逐步被羟基取代,最后生成三聚氰酸,则三聚氰酸分子式为,C3H3N3O3
8.若a A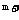 与b B
与b B 的核外电子排布相同,则下列关系不正确的是 ( )
的核外电子排布相同,则下列关系不正确的是 ( )
A.离子半径A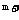 <
B
<
B
B.原子半径A<B
C.A的原子序数比B大
D.若B为F,则A可能是Na或Mg或A1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com