
4.下列化学用语表达正确的是 ( )
A.HClO的电子式:
B.丙烷分子的比例模型:
C.Ar原子的结构示意图: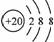
D.北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O
3.共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种作用力的晶体是 ( )
A.SiO2晶体 B.CCl4晶体 C.NaCl晶体 D.晶体硅
2.下列排列顺序错误的是 ( )
A.非金属性 As>S>Cl>F B.金属性 Rb>K>Mg>Al
C.稳定性 AsH3<PH3<H2S<HF D.半径 Na>P>O>F
1.下列分子中所有原子均满足最外层8电子结构的是 ( )
A.LiCl B.NCl3 C.PCl5 D.BF3
30.(10分)江苏东海有蛭石。蛭石为一种层状结构的含镁的水铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/3的Si被Al置换,再由K平衡其电荷形成的。该矿石得组成以氧化物的形式表示为 。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
 ① 固体A的化学式是
① 固体A的化学式是
② 固体F的物质的量是
③ 通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。
29.(6分)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
(1)加入铝粉的质量。
(2)原硫酸铜溶液的物质的量浓度。
28.(8分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解 ③HClO2在25℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
(1)160g/LNaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个数据是 。
(2)ClO2发生器中所发生反应的化学方程式为 。
(3)吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2·3H2O晶体还必须进行的操作是 (填操作名称)。
27.(10分)某同学设计下图装置进行探究。(夹持装置已略去)

(1)进行“铜和稀硝酸反应制取NO”的实验。
①制取NO的化学方程式:
②收集气体前必须先 然后才开始收集气体。
(2)利用该装置制取并收集少量其他气体,请完成下表:
|
制取气体 |
药品 |
|
O2 |
、
|
|
|
某溶液、Al |
(3)利用该装置进行实验,并根据产生氢气的量来确定某酸的结构:
①反应前,先对量气管进行第一次读数。读数时,应注意的操作是
,并使视线与凹液面最低处相平;反应后,待
时,再对量气管进行第二次读数。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
|
编号 |
酸的质量 |
金属锌的质量 |
量气管第一次读数 |
量气管第二次读数 |
|
1 |
1.45g |
10.0g(足量) |
40mL |
264mL |
|
2 |
1.45g |
10.0g(足量) |
30mL |
228mL |
|
3 |
1.44g |
10.0g(足量) |
20mL |
243mL |
已知该酸的相对分子质量为145。根据上述数据可确定该酸是 元酸;
③如果第二次对量气管读数时仰视,则测得的气体体积会 (填“偏高”、“偏低”或“不能确定”)。
26.(6分)A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子数是内层电子数的3倍。C原子的最外层电子数是内层电子数的一半,且C元素是植物生长的营养元素之一。D原子是短周期元素中原子半径最大的原子(除稀有气体)。
试写出:
(1) A、B元素形成的酸酐的化学式 ;
(2) D元素的单质与水反应的化学方程式 ;
(3) A、C元素气态氢化物的稳定性大小 < (用分子式表示)。
25.(8分)2007年2月27日某市工商局查获400克袋装中老年补钙营养奶粉1401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。NaNO2有像食盐一样的咸味。已知NaNO2能发生如下反应:2NaNO2
+ 4HI 2NO + I2
+ 2NaI+ 2H2O
2NO + I2
+ 2NaI+ 2H2O
(1)上述反应中氧化剂是 ,若有0.75mol的还原剂被氧化,则被还原的氧化剂是 mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒。
进行实验时,必须选用的物质有 。(填序号)
(3)某厂废切削液中,含2%-5%的NaNO2,直接排放会造成污染,下列试剂 (填序号)能使NaNO2转化为不引起二次污染的N2 。
① NaCl ② NH4Cl ③ H2O2 ④ 浓H2SO4。
反应的化学方程式为: (并标出电子转移的数目和方向)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com