
4.下列有关铝及其化合物的叙述正确的是 ( )
A.铝粉与氧化镁共热可制取金属镁
B.足量铝分别与含1molHCl、1molNaOH的溶液反应,产生相同量的氢气
C.工业上用电解熔融Al2O3的方法冶炼铝
D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化
3.下列变化中,属于物理变化的是 ( )
①红磷加热升华变成白磷
②氯化铵晶体受热后由试管底部移到试管上部
③固体碘受热变成紫红色气体
④液氨气化
⑤浓硝酸从无色液体变成黄色液体
A.①③④ B.③④ C.②③④ D.③④⑤
2.下列试剂:①浓HNO3 ②AgNO3 ③KNO3 ④氯水 ⑤氨水 ⑥NaHCO3
应避光保存的是 ( )
A.①②③ B.④⑤⑥ C.①②④ D.②③⑥
1. 俄罗斯杜布纳核研究所和美国劳伦斯利弗莫尔实验室的科学家在2004年2月的美国《物理评论C》杂志上发表文章宣布, 他们新合成了元素周期表上的第115号和第113号元素。科学家在利用回旋加速器进行的实验中,用具有20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为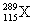 。下列有关叙述正确的是
( )
。下列有关叙述正确的是
( )
A.115号元素衰变成113号元素是化学变化
B.核素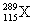 中中子数与质子数之差为174
中中子数与质子数之差为174
C.113号元素最高正价应为+3
D.115号与113号元素的原子质量比为115:113
31.(12分)分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
(2)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);

(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=________________;(结果保留一位小数)
(4) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
30.(15分)侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:

(1)“侯氏制碱法”中的“碱”其实不是烧碱,而是纯碱,请写出向它的溶液中滴加少量稀盐酸的离子方程式_________
(2)某化学研究性学习小组在老师的指导下,模拟侯德榜先生制碱原理设计了如上图的实验装置。A.写出有关仪器的名称:a______________,b_________________。
B.实验的操作步骤中,你认为打开旋塞K1、K2的合理顺序应为:
先打开______, 后打开______.(填字母代号)。简述理由:_____________________
C.在盛饱和食盐水的装置中发生反应的化学方程式为装置中气胆的作用是
D.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其它原料用工业常用 方法制取,写出工业制备两种原料气的主要化学反应方程式。
29.(9分)A、B、C、D均为短周期主族元素,A、C、D在不同周期,A和C同主族,B、C同周期,A、B、C三种元素的原子序数之和为37,且B元素的最外层电子数与其电子层数相同。请回答:
(1)D元素的名称为 。
(2)元素A、D形成的化合物D2A的熔点比D2C的熔点 (用“高”或“低”填写)
理由是(请结合图示说明) 。
(3)A、B、C三种元素所形成的常见化合物溶于水呈酸性,用离子方程式表示其原因
。
(4)A、B、C、D四种元素的简单离子的半径从小到大的顺序是 (用元素符号表示)
28.(10分)
(1)白磷分子中的键角为 ,分子的空间构型为 ,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合 个氧原子, 若每个P原子上的孤对电子再与氧原子形成配位键,就可以得到磷的另一种氧化物 (填分子式)。
(2)元素周期表是学习化学的重要工具之一,掌握其结构和递变规律是运用周期表的前提。
请按要求回答下列各题:
①写出下面各周期或族所包含的元素种数:第3周期________,第6周期_____ __,I A族__________。
②已知A、B分别是周期表中同周期的II A族、III A族元素,原子序数分别为m和n,则n-m的值可能是_________。
27.已知溶质质量分数为98%的浓硫酸(ρ=1.84g/cm3),其物质的量浓度为18.4mol/L,取10ml该硫酸与aml水混合,配制成溶质质量分数为49%的硫酸(ρ=1.40g/cm3),其物质的量浓度为bmol/L,则a,b分别为 ( )
A.a=10 b=9.2 B.a<10 b>9.2
C.a>10 b<9.2 D.a>10 b=9.2
|
26.把一定量某碱金属与2.7g铝的混合物放入足量水中,金属全部溶解,收集到标准状况下的气体5.6L,向所得溶液中通入过量二氧化碳,过滤,把滤液减压低温蒸发得固体20g,则此碱金属相对原子质量为 ( )
A.7 B.23 C.39 D.85
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com