
21.(10分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.2000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00ml
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe+7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式
。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%硫酸质量为 t,SO2全部转化为H2SO4时发出的热量是 kJ。
20.(4分)20℃时食盐的溶解度为36g,取一定量该温度下的饱和溶液,用惰性电极电解,当阳极析出11.2L气体(标准状况下)时,食盐完全电解,所得溶液的密度为1.1g/ml。
(1)写出两电极反应,阳极 ,阴极 。
(2)计算电解后溶液中NaOH的物质的量浓度 (取两位小数)。
19.(12分)NO很容易与许多分子迅速发生反应,科学家发现在生命体终会不断的产生NO,用于在细胞和细胞传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的化学方程式: 。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置在进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是 (填选项编号)
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色,原因是(填化学方程式): 。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某同学设计了一套如图所示制取NO的装置。反应开始后,可以再U形管右端观察到无色的NO气体。

①长玻璃管的作用是 。
②让反应停止的操作方法及原因是 。
(4)以下收集NO气体的装置,合理的是 (填选项代号)

18.(10分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体。

请回答下列问题:
(1)A元素在周期表中位于 周期 族。
(2)以F饱和溶液制备M胶体的操作为 。
(3)鉴别L溶液和N溶液的最简单的物理方法是 。
(4)反应③的离子方程式为 。
(5)已知:在通常情况下,反应②中1molG物质发生反应,放出akJ热量,则该反应的热化学方程式为 。
17.(16分)某兴趣小组同学共同设计了如图所示的试验装置。该装置即可用于制取气体,又可用于验证物质的性质。

(1)打开K1关闭K2,可制取某些气体。甲同学认为装置Ⅰ可用于制取H2、O2、,但装置Ⅱ只能收集H2,不能收集O2。其理由是 。
乙同学认为在不改动装置Ⅱ仪器的前提下,对装置Ⅱ进行适当改进,也可收集O2。你认为他的改进方法是 。
(2)打开K2关闭K1,能比较一些物质的性质。丙同学设计实验比较氧化性:KMnO4>Cl2>Br2,操作步骤为 ,实验现象为 ,但此实验的不足之处是 。
(3)丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验,它的实验目的是
。有关的离子反应方程式是 。
16.FeS与一定浓度HNO3溶液反应,生成Fe2(SO4)3,Fe(NO3)3,NO2,NO和H2O,当NO2和NO的体积比为1:1时,实际参加反应的FeS和HNO3的物质的量之比是( )
A.4:9 B.2:9 C.2:11 D.1:7
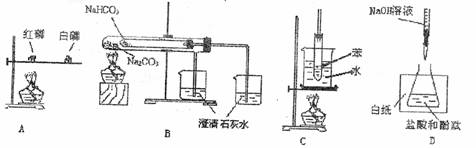
15.对照实验是研究物质性质的一种重要方法,下列不是用来做对照实验的是 ( )
14.已知反映:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol。下列结论正确的是 ( )
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热应为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.2 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
13.已知土壤胶粒带负电荷,因此水稻田中,施用含氮量相同的下列化肥时,肥效损失最多的是 ( )
A.硫铵 B.碳铵 C.硝铵 D.氯化铵
12.下列实验操作方法(指主要操作)中错误的是 ( )
A.用过滤法分离KMnO4受热分解后的产物
B.用升华法分离NaCl与碘的混合物
|
D.用分液法分离C2H5Br和C2H5OH的混合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com