
28.锈铁片(铁锈为氧化铁)置于稀硝酸中,反应结束后收集到1.12LNO(标准状况),溶液中还剩下4g单质铁。取出铁后,向溶液中通入10.65gCl2,恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+反应)。计算:
(1)锈铁片中铁单质的质量。
(2)锈铁片中铁锈的质量分数。
27.(14分)为了测定氢氧化钠固体混合物mg中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:

(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施 ;
(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①
②
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品mg,放入锥形瓶中蒸馏水溶解,加1-1滴酚酞指示剂,用物质的量浓度为cmol/L的HCl溶液滴定至溶液由红色至无色(指示CO32-+H+=HCO-3反应的终点),消耗HCl溶液体积为V1mL,再加入1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++HCO-3=CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2ml。则烧碱样品中Na2CO3的质量分数为 ;
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤
②用测得的数据(用字母表示)写出质量分数的表达式 。
26.(13分)某无色溶液,其中可能含有的离子如下:Na+、Ag+、Fe3+、Al3+、AlO-2、S2-、SO2-3、SO2-4,现取该溶液进行有关实验,其结果如下:
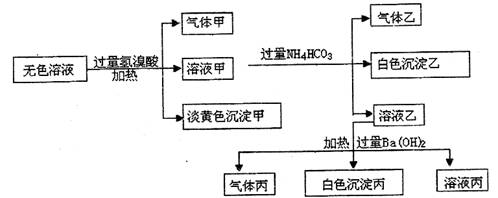
(1)沉淀甲是 (填化学式),生成甲的离子方程式为:
。
(2)沉淀乙是 (填化学式),生成乙的离子方程式为:
。
(3)沉淀丙可能是 (填化学式)。
(4)气体甲的成分有哪几种可能?
① ,② ,③ 。(有几种填几种,可不填满)
(5)综合上述信息,可以肯定溶液中存在的离子有 。
25.(4分)完成并配平下列方程式:
Na2Sx+ NaClO+ NaOH = Na2SO4+ NaCl+ H2O
NaBiO3+ MnSO4+ = NaMnO4+ Bi2(SO4)3+ Na2SO4+ H2O
24.(6分)某溶液只可能含有以下离子中的若干种:K+、NH+4、Cl-、Mg2+、Ba2+、CO32-、
SO2-4,现取三份溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成。
(2)第二份加入足量NaOH溶液并加热后,收集到气体0.04mol。
(3)第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。根据上述实验,作出判断:
该溶液中一定存在的离子是
该溶液中一定不存在的离子是
该溶液中可能存在的离子是
23.(11分)工业上用接触法制硫酸的生产过程主要分为造气、接触氧化和吸收三个过程,若将三个过程中所使用的主要设备依次记为设备A、设备B和设备C,填写下列空白。
(1)设备A的名称是 ,写出在其中进行的化学反应方程式并标出电子转移 。
(2)从设备A里放出的气体必须经过 、 处理后,才能进入设备B,其原因是 。
(3)设备B的名称是 ,其中部的装置叫做 ,应用相同原理的化学实验仪器叫 。
(4)设备C的名称是 ,在其中选择98.3%的硫酸吸收SO3的原因是
。
22.(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是 ( )
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
第Ⅱ卷(共56分)
21.甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl‑ D.Cl-、I-、Br-
20.限用一种试液区别Na2S、Na2S2O3、Na2CO3、NaAlO2、Na2SO4五种溶液,应选用( )
A.烧碱溶液 B.盐酸 C.氨水 D.氯化钡溶液
19.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是 ( )
A.NO2 B.NO C.N2O D.N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com