
9.25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是 ( )
A.该溶液的pH可能是7 B.该溶液的pH可能是5
C.该溶液的pH一定是9 D.此溶液不存在
8.下列离子方程式书写正确的是 ( )
A.碳酸氢钠溶液中加入过量的石灰水:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.氯化铝溶液中加入过量氨水:
A13++4NH3·H2O=A1O2-+4NH4++2H2O
C.苯酚钠溶液中通入少量二氧化碳:

D.钠与水反应:
2Na+2H2O=2Na++2OH-+H2↑
7.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是 ( )
A.标准状况下22.4L NO与11.2L O2混合后所得气体分子数为6.02×1023
B.标准状况下3.36CC14中所含碳原子数为0.15×6.02×1023
C.1 mol甲基(-CH3)中所含电子数为9×6.02×1023
D.2L、1mol·L-1的盐酸中所含氯化氢分子数为2×6.02×1023
6.2004年4月15日重庆发生的氯气泄漏事故、2004年4月20日江苏扬州发生的氨气泄漏事故再一次给安全生产敲响了警钟。下列有关氯气和氨气的说法中正确的是( )
A.氯气和氨气都是易液化的气体
B.氯气和氨气都是无色、密度比空气大的有毒气体
C.氯气和氨气都是由极性键构成的非极性分子
D.氯气和氨气分子中所有原子都满足最外层为8电子的结构
26.(共12分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2 混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
25.(共10分)物质之间的转化关系如下图所示,A是工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的无色医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见有机氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。

回答下列问题:
(1)X的化学式为_______________,O的化学式为
(2)反应②的化学方程式为____ _______ __;
(3)反应③的化学方程式为____ _______ __;
(4)反应⑦的化学方程式_____________________________________;
24.(共18分)A、B、C、D、E是元素周期表中短周期元素,原子序数依次增大。
|
元 素 |
结构 或 性质 |
|
B |
原子最外层电子数是电子层数的两倍 |
|
C |
C和A形成的化合物甲,空间构型为三角锥型 |
|
D |
地壳中含量最多的元素 |
|
E |
原子的质子数为D的两倍 |
(1)甲的电子式是 。
(2)D的非金属性比E的非金属性 (填“强”或“弱”),并用化学方程式说明此结论 。
(3)液态C2A4在空气中燃烧时生成气体C2和液态水并放出大量的热,是一种高能燃料。已知0.5 mol液态C2A4燃烧可放出314.5 kJ 热量,表示该反应的热化学方程式是
。
(4)B的单质在D的单质中完全燃烧生成乙。用下图所示装置(夹持仪器未画出)可以制取并收集气体甲或气体乙。若制取 (填化学式),则烧瓶中应加入固体 ,分液漏斗中应加入 。请在下图方框中画出用集气瓶收集相应气体的装置图。

(5)4n mol 气体甲与2n mol 气体乙反应可以生成2n mol 水和物质丙,丙的摩尔质量为
60 g / mol,则丙的分子式为 。
23.(共14分)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色;
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是______________。
22.(共6分)某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:①SO2+2Fe3++2H2O==SO42-+2Fe2++4H+
② Cr2O72-+ Fe2++ H+== Cr3++ Fe3++ H2O
(1)在反应②的横线上填写相应的化学计量数。
(2)样品中FeS2的质量分数为 。
(3)该厂制硫酸煅烧时硫的利用率为94%,二氧化硫氧化成三氧化硫时损失硫2%,要制取1t98%的浓硫酸,需这种硫铁矿 t.
21.下图进行实验,试管内装有12mLNO,然后间歇而缓慢地通入8mLO2。下面有关实验最终状态的描述正确的是 ( )
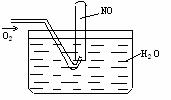
A.试管内气体呈棕红色 B.试管内气体为无色是NO
C.试管内气体为无色是O2 D.试管内液面高度上升
第Ⅱ卷(非选择题 共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com