
7.下列叙述正确的是
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极
6.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
5.实验室现有3种酸碱指示剂,其pH的变色范围如下:
甲基橙:3.1-4.4 石蕊:5.0-8.0 酚酞:8.2-10.0
用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
4.醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
3.X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
A.33% B.40% C.50% D.65%
2.已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H= - 1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g) △H= - 1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是

1.“嫦娥一号”的成功发射,标志着我国已具有深太空探测能力。据科学家预测,月球的土壤中吸附着百万吨的3He,每百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法正确的是
A.4He原子核内含有4个质子 B. 3He和4He互为同位素
C. 3He原子核内含有3个中子 D.4He比3He多一个电子
30.[化学选修-有机化学基础]丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如下图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N)
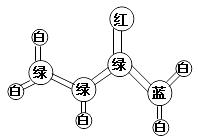
(1)丙烯酰胺的分子式为 ,结构简式为
(2)有关丙烯酰胺的说法正确的是( )
A.丙烯酰胺分子内所有原子不可能在同一平面内
B.丙烯酰胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酰胺能够使溴的四氯化碳溶液褪色
(3)工业上生产丙烯酰胺的方法之一是(反应均在一定条件下进行):
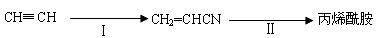
反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为 ,反应Ⅱ的方程式为
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式 .
29.[化学选修-物质结构与性质]
元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。根据以上信息,回答下列问题:
|
|
|
|
…… |
|
A |
|
|
B |
|
C |
D |
|
|
(1)上述A、B、C、D四种元素中第一电离能最小的是 ,电负性最大的是 。(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:

阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物化学式为____。
28.[化学--化学与技术]
海水中镁的总储量约为2.1×1015t,目前世界上的60%的镁来自海水。工业规模海水提镁的流程(如图所示),其步骤为:①将海水中大量存在的贝壳煅烧成石灰;②将石灰制成石灰乳;③将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;④在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;⑤将MgCl2·6H2O在一定条件下加热得到无水MgCl2;⑥电解熔融的MgCl2可得到镁。
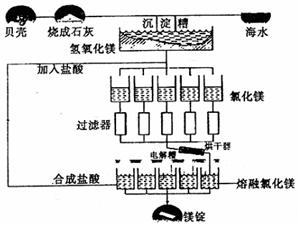
试回答下列问题:
(1)请写出海水提镁的过程中①⑥反应的化学方程式:① ; ⑥ 。
(2)工业上采用电解MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为: ;
(3)步骤④中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有________ __________ __________ ___________ 铁架台等;
(4)步骤⑤中的“一定条件”指的是_________________目的是______________;
(5)上述制镁的流程中,可以在降低成本,减少污染方面做出一些工作,请写出其中一点________________;
(6)有同学认为上述过程中,可加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什 么?
______________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com