
1.2007年4月,某地发生了导致四人死亡、一百多人中毒的食用熟牛肉中毒事件,经过对该牛肉的检测,发现某盐的含量比国家允许标准高800多倍,该盐可能是 ( )
A.NaCl B.NaNO2 C.NaNO3 D.BaSO4
32.化学选考题:
A.(化学与生活)分析下面两个案例并回答有关问题。
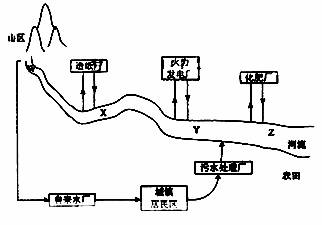
(1) 某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。
|
地点 项目 |
W |
X |
Y |
Z |
|
水温/℃ |
15 |
18 |
26 |
25 |
|
pH |
6 |
8 |
5 |
5 |
|
溶解氧量/(mg·L-1) |
11 |
9 |
7 |
3 |
①导致X、Y处水样pH变化的原因可能是 ;
②Z处鱼类大量减少,产生这种现象的原因可能是 。
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O2,还含有SiO2等杂质)、煤 矿、石灰石和黏土。拟在该地区建设大型炼铁厂。

①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定上图中相应工厂的名称A 、B 、C 、D ;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式 ;
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出2种措施即可) 。
B.(物质结构)
元素A-D是元素周期表中短周期的四种元素,请根据表中的信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
物质或结构信息 |
单质制成的的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 |
单质常温、常压下是气体,原子的L层有一个未成对的 电子 电子 |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是_____________(写元素符号)(2分),写出D离子的电子排布式______________________。(2分)
(2)D和C形成的化合物属于________晶体(2分)。写出C单质与水反应的化学方程式_________________________(3分)。
(3)对元素B的单质或化合物描述正确的是_________。(2分)
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是(写元素符号)_____。(2分)写出能证明该结论的一个实验事实________________。(2分)
C.(有机化学)
A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R'为烷基)。

回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为________;(2分)B的结构简式是______(2分)
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是_______,(3分)反应类型为_____:(2分)
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式__ _(2分)
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有__________种,(2分)其相应的结构简式是__________________。(2分)
27.(23分)实验室模拟合成氨和氨催化氧化的流程如下:
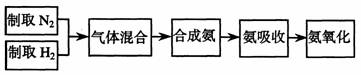
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。

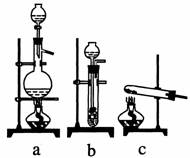
(1)从下图中选择制取气体的合适装置:氮气 (2分)、氢气 (2分)
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 (2分)、 (2分)
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (2分)(“会”或“不会”)发生倒吸,原因是: (2分)。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: (2分),锥形瓶中还可观察到的现象是: 。(2分)
(5)写出乙装置中氨氧化的化学方程式: (3分)
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。(各2分)
选考题(每科选做1题)
26.(10分)某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下:

依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀) (2分),原因是 (2分)。
a.减少过程中产生NOx 的量
b.减少原料银的消耗量
c.节省硝酸物质的量
(2)步骤B加热保温的作用是 . (2分)
a.有利于加快反应速度
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C是为了除去Fe3+、Cu2+ 等杂质.冲稀静置时发生的化学反应是 (选类型)(2分),产生的沉淀物化学式 。(2分)
a. 置换反应 b. 水解反应 c. 氧化-还原反应
25.(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)(2分)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)(2分)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。(写出计算过程)(4分)
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(不要求过程)(2分)
13.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷
12.如下图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是 ( )
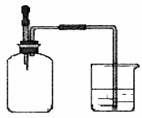
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②③ C.③④ D.②④
11.在一个6L的密闭容器内,放入3LX(气)和2LY(气),在一定条件下发生下列反应:4X (气)+
3Y(气) 2Q(气)+ nR(气)达平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是 ( )
2Q(气)+ nR(气)达平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是 ( )
A. 3 B. 4 C. 5 D. 6
10.下列反应的离子方程式错误的是 ( )
A.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3•H2O == AlO2- + 4NH4+ + 2H2O
B.用氨水吸收过量的二氧化硫 NH3•H2O + SO2 == NH4+ + HSO3-
C.碳酸钠溶液中加入过量的苯酚 C6H5-OH + CO32- == C6H5O- + HCO3-
D.次氯酸钙溶液中通入过量的二氧化碳 ClO- + CO2 + H2O == HCO3- + HClO
9.若阿伏加德罗为NA,下列说法不正确的是 ( )
A.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.32g铜和足量硫完全反应,转移的电子数为0. NA
C.常温7.8g Na2O2与水充分反应转移电子数为0.1NA
D.1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com