
8.下列分子中所有原子都满足8电子结构的是 ( )
A.NH3 B.SiCl4 C.BF3 D.PCl5
7.已知自然界氧的同位素有16O、17O、18O三种,水中氢的同位素有H、D两种,则自然界的水分子共有 ( )
A.3种 B.6种 C.9种 D.12种
6.下列说法中正确的是 ( )
A.碱性氧化物一定是金属氧化物 B.金属氧化物一定是碱性氧化物
C.酸性氧化物一定是非金属氧化物 D.非金属氧化物一定是酸性氧化物
5.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三元素的原子序数的关系是 ( )
A.X>Z>Y B.Y>X>Z C.Z>X>Y D.Z>Y>X
4.1996年2月,德国达姆施塔特重离子研究所就合成出当时最重的人造元素,它是由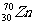 撞击
撞击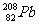 的原子核而产生的一种新元素的原子,并同时释放出一个中子。该元素原子的核电荷数为 ( )
的原子核而产生的一种新元素的原子,并同时释放出一个中子。该元素原子的核电荷数为 ( )
A.114 B.113 C.112 D.111
3. 1838年3月纽卡斯市的一些园艺家访问大物理学家法拉第,向他请教一个奇特而有趣的问题:为什么别处生长的紫罗兰都是紫色的,而生长在纽卡斯市的紫罗兰花却是白色的?法拉弟经过一番研究得出结论,后来被化学家证实并在工业上广泛应用,法拉弟的结论是 ( )
A.遗传变异 B.施花肥不当
C.纽卡斯市空气中SO2含量较高 D.水质问题
2.下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
1.下列各组物质,前者是混合物,后者是纯净物的是 ( )
A.胆矾 玻璃 B.汽油 液氯 C.石油 盐酸 D.干冰 铝热剂
20.(9分)在Cu +
2H2SO4(浓) CuSO4
+ SO2↑+ 2H2O反应中,
CuSO4
+ SO2↑+ 2H2O反应中,
(1) 元素被氧化, 是氧化剂。
(2)用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓) CuSO4
+ SO2↑+ 2H2O
CuSO4
+ SO2↑+ 2H2O
(3)某一反应体系有反应物和生成物的粒子共六种:SO32-、I2、H+、SO42-、I-、H2O。
已知该反应中I2只发生如下过程:I2 →I-,请回答:
(1)该反应中的还原剂是 (填分子或离子符号)
(2)写出该反应的离子方程式
19.(18分)在一定条件下可实现下图所示物质之间的变化。其中甲、乙是生活中最常见的金属,丙是气体单质,其它字母表示化合物,其中A是红棕色固体。

填写下列空白:
(1)单质乙的化学式是 ,其在周期表中的位置是 ;
(2)写出反应②、③的离子方程式
② 。
③ 。
(3)反应①的化学方程式是 。
(4)反应④过程中看到的现象是 。
(5)检验D中阳离子的方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com