
1.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
29.(17分)某学生欲配制6.0mol·L-1的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL 0.5 mol·L-1的硫酸;②150mL 25%的硫酸(ρ=1.18g·mL-1);③足量的18 mol·L-1的硫酸。有三种规格的容量瓶:25mL、500mL、1000mL。老师要求把①、②两种硫酸全部用完,不足的部分由③来补充。请回答下列问题:
(1)实验中25%的硫酸的物质的量浓度为 mol·L-1(保留1位小数)
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学操作顺序如下,并将操作步骤D补充完整。
A.将①、②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol·L-1的浓硫酸 mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅动,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加入,直到液面接近刻度线1~2cm;
F.改用胶头滴加水,使溶液的凹液面恰好与刻度相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D对所配溶液浓度有何影响: 。(填“偏大”“偏小”或“无影响”)
(5)进行操作C前还需注意 。
28.(16分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子最外层电子数与次外层电子数之比为3:4,N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化合中酸性较强的是(写酸的化学式) 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 。
(3)已知通常状况下1gX2在Y2中完全燃烧放出akJ的热量,请写出表示X2燃烧热的热化学方程式 。
(4)X与Y、X与M均可形成18电子分子,该两种分子在水溶液中反应有淡黄色沉淀生成,写出该反应的化学方程式 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质的水溶液均显碱性,组成元素的原子数目之比均为1:1:1,A中有一种离子与B中的离子相同。则化合物A中的化学键类型为 , ;若B为常见家用消毒剂的主要成分,则B的化学式是 。
27.(15分)某无色溶液中含有K+、Cl-、OH-、SO2-3、SO2-4,为检验溶液中所含有的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
① ,② ,③ ,④ ,⑤
(2)图中现象a、b、c表明检验出的离子分别是:
a ,b ,c
(3)白色沉淀A与所加试剂②反应的离子方程式是
(4)无色溶液B加剂③的主要目的是
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是
26.(12分)下表是某食用碘盐包装袋上的部分说明:
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,
在一定条件下电解,反应的方程式为:KI+3H2O KIO3+3H2↑。则阳极所用电极为
。
KIO3+3H2↑。则阳极所用电极为
。
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式。
KIO3+ KI+ H2SO4= K2SO4+ I2+H2O
(4)已知:I2+2S2O2-3=2I-+S4O2-6。某学生测定食用碘盐中碘的含量,其步骤为:
a. 准确称取w g食盐,加适量蒸馏水使其完全溶解
b. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c. 以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数表示) mg/kg。
13.下列有关铁元素的叙述中正确的是 ( )
A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX2
B.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2O
C.氢氧化铁可以由相关物质通过化合反应而制得
D.铁元素位于周期表的第四周期第VIIIB族
12.在水溶液中YOn-3与S2-发生反应的离子方程式如下:YOn-3+3S2-+6H+=Y-+3S↓+3H3O,则YOn-3中Y元素的化合价和Y元素原子的最外层电子数分别是 ( )
A.+5、4 B.+5、7 C.+5、5 D.+7、7
11.在下列实验中,不能达到目的的是 ( )
A.用金属钠分别与水和乙醇反应,确定水和乙醇分子中羟基氢的活泼性强弱
B.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
D.为确定溴乙烷中含有溴元素,向该溴乙烷中加入NaOH水溶液后,再加入AgNO3溶液
10.下列离子反应方程式正确的是 ( )
A.碘化亚铁溶液中通入少量的氯气Fe2++Cl2=Fe3++2Cl-
B.氯化铝溶液中加入过量氨水Al3++3NH3·H2O=Al(OH)3↓+3NH+4
C.小苏打溶液中加入过量石灰水2HCO-3+Ca2++2OH-=CaCO3↓+CO2-3+2H2O
D.苛性钾溶液中加入稀醋酸H++OH-=H2O
9.下列有关下图装置(瓶口向上)的说法正确的是( )
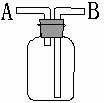
A.从A口进气,B口出气,可以收集密度比空气大的气体
B.在广口瓶中盛有浓硫酸,可以用于干燥H2S气体
C.若广口瓶中充满水,从A口进气可以用于测定O2的气体
D.若广口瓶中盛有NaOH水溶液,可用于Cl2中的HCl气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com