
1.在化学反应中,反应前与反应后相比较,肯定不变的是
①元素的种类 ②原子的种类 ③分子的数目 ④原子的数目
⑤反应前物质的质量总和与反应后物质的质量总和
⑥如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
A.①②③④ B.①②⑤⑥ C.①②④⑤ D.②③⑤⑥
31.(15分)某化学兴趣小组的同学利用下图所示实验装置进行物质的制备、性质等实验。请按要求填空。
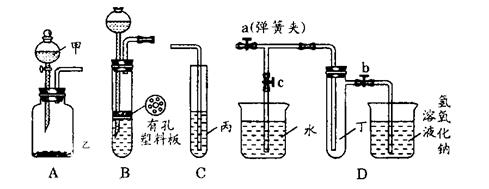
(1)利用A或B装置可制取的气体有 。(写出两种即可)
(2)A、C装置相连后可完成多种实验。
①在甲、乙、丙中分别盛装的试剂为稀盐酸、石灰石、次氯酸钙溶液,则实验开始后试管中可观察到的现象为 该实验可说明相关酸的酸性强弱顺序是
②已知KMnO4在常温下可与浓盐酸反应生成Cl2,请利用该装置设计一个简单的实验验证KMnO4、Cl2、Br2的氧化性强弱。在甲、乙、丙中分别装入 、 、 ,反应中若观察到广口瓶A中的现象是 试管C中的现象是 ,则可证明氧化性的强弱为KMnO4>Cl2>Br2
(3)当B中盛装浓硝酸和铜片(放在有孔塑料板上)后,可验证铜和浓硝酸反应生成了NO2
①B、D装置相连后,可进一步验证NO2和水的反应。操作步骤为:先关闭弹簧夹 再打开弹簧夹 使NO2气体充满试管丁,接着关闭弹簧夹a、b,打开弹簧c,然后 使烧杯中的水倒流入试管丁。
②当试管中的NO2和水充分反应后,所得溶液中溶质的物质的量浓度的最大值是
(计算时气体按标准状况对待)。
30.(3分)下列有关化学实验的基本摄作或物质分离提纯的方法正确的是 (填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来;
②水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精;
③用玻璃棒蘸取待测液后,点在用蒸馏水润湿的pH试纸上,观察颜色变化并与标准比色卡比较测得该溶液的pH
④用排饱和食盐水的方法收集氯气可除去氯气中混有的少量氯化氢气体;
⑤配制一定物质的量浓度的溶液时,用蒸馏水把容量瓶洗涤干净后,不经干燥直接使用;
⑥除去FeC13溶液中混有的少量FeC12:加入适量的氯水。
⑦硫酸铜晶体生结晶水含量的测定实验中,加热后所得的固体在空气中冷却后称量,会引起实验结果偏大。
29.(6分)甲、乙、丙、丁四种短周期元素在周期表中的位置关系如图所示(其中乙、丙、丁位置未标出)。已知四种元素的原子序数之和为40,丁的原子序数与乙、丙原子序数之和相等。

(1)甲元素在周期表中的位置是 。
(2)乙、丙两元素可形成AB3型化合物,其化合物分子是 (填“极性”或“非极性’’)分子。
(3)这四种元素中按原子个数比1:2两两化合时能形成多种化合物分子,其中价电子数之和为偶数的有 、 (举两例;写化学式)。
(4)丁元素最高价氧化物水化物的浓溶液与丁单质共热时反应的化学方程式为 .
28.(6分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其它元素既不在同周期也不在同主族,D的氢化物和最高价氧化物的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D氢化物中, 沸点较低的是 (选“A”或“D”)
(2)元素C在元素周期表中位置是 ,B的最高价氧化物的水化物的电子式为
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:l,该盐的名称为 .它的水溶液与D的氢化物的水溶液反应可生成D的单质.该反应的离子方程式为:
26.(一)(6分)KClO3和浓盐酸在一定温度下反应生成绿黄色的易爆物二氧化氯。其变化可表述为: KClO3+ HCl(浓)→ KCl+ ClO2↑+ Cl2↑+ A
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是 (填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍(保留小数点后两位)。
23.下列关于粒子的描述不正确的是 ( )
A.H2O和NH3均是极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CO2和C2H2均是直线型分子
D. 分子中所含有中子,质子,电子的数目均相等
分子中所含有中子,质子,电子的数目均相等
24.下列叙述中错误的是: ( )
A.CO2和H2O晶体中,化学键类型相同、晶体类型也相同
B.在原子晶体中可能存在极性共价键
C.某化合物晶体熔融状态时能导电,该化合物中一定存在离子键
D.在晶体中只要有阳离子就一定有阴离子
25.下列说法正确的是 ( )
A.200ml 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为6.02×1023
B.标准状况下,22.4LCl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1mol Br原子中含中子数为3.5×6.02×1023
Br原子中含中子数为3.5×6.02×1023
D.30g甲醛中含共用电子对总数为4×6.02×1023
22.已知(1)
(2)
(3)
(4)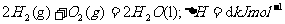
下列关系式正确的是 ( )
A. B.
B.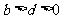 C.
C. D.
D.
21.关于晶体的下列说法正确的是 ( )
A.在晶体中一定存在化学键 B.在晶体中只要有阴离子就一定有阳离子
C.原子晶体的熔点一定金属晶体的高 D.离子晶体中一定含有离子键,不含共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com