
28.(10分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡 移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/ c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲) pH(乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙) (填“大于”、“小于”或“等于”)。
(4)取25 mL甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+) c(CH3COO-)(填“大于”、“小于”或“等于” )。
27.在100mLCaCl2和盐酸的混合液中加入Na2CO3溶液时,测得生成沉淀和所加入Na2CO3溶液的体积曲线关系如图所示。若CaCl2的浓度为0.25mol/L,则原溶液的pH为 ( )

A.0 B.1 C.2 D.3
Ⅱ卷(共 46 分)
26.已知HA的酸性比HB弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是 ( )
A.c(OH-) > c(HA) > c(HB) > c(H+)
B.c(OH-) > c(A-) > c(B-) > c(H+)
C.c(OH-) > c(B-) > c(A-) > c(H+)
D.c(OH-) > c(HB) > c(HA) > c(H+)
25.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种:①在原来溶液中滴加足量的饱和氯水,有气泡生成,溶液呈现橙黄色
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成
③橙黄色溶液不能使淀粉溶液变蓝色。
根据上述实验事实推断,下列说法不正确的是 ( )
A.溶液中一定存在Br-、CO32- B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32- D.溶液一定呈碱性
24.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系如下图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
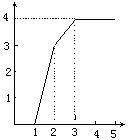
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
23.设NA代表阿伏加德罗常数的数值,下列说法中正确的是 ( )
①常温常压下,17克甲基(-14CH3)所含的中子数为9NA
②常温常压下,22.4 LNO气体的分子数小于NA
③64克铜发生氧化还原反应,一定失去2NA个电子
④1molSiO2晶体中含有的Si-O共价键数目为4NA
⑤1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子数目为NA
⑥常温常压下, 1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
22.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g)  2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时HI的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时HI的体积分数也为φ的是、( )
2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时HI的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时HI的体积分数也为φ的是、( )
A.2 mol H2和1 mol I2(g) B.3 mol HI
C.2 mol H2和2 mol I2(g) D.1 mol I2(g)和2 mol HI(g)
21.在t1℃时反应2A(g) B(g)达到平衡,混合气体的平均相对分子质量为M1,t2℃时设反应平衡后混合气体的平均相对分子质量为M2,当温度从t1℃升高到t2℃时,下列说法正确的是 (
)
B(g)达到平衡,混合气体的平均相对分子质量为M1,t2℃时设反应平衡后混合气体的平均相对分子质量为M2,当温度从t1℃升高到t2℃时,下列说法正确的是 (
)
A.若M1>M2,平衡右移,正反应吸热
B.若M1<M2,平衡左移,正反应吸热
C.若M1>M2,平衡左移,正反应放热
D.若M1<M2,平衡右移,正反应放热
20.将20克NaOH固体溶解于足量水中,并通入足量CO2气体,生成的溶液中各微粒浓度关系正确的是 ( )
A.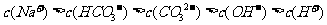
B.
C.
D.c(OH -)=c(H +)+c(HCO3-)+c(H2CO3)
19.在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲、乙、丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲、乙、丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
|
容 器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( )
A.Q1=2Q2=2Q3=197KJ
B.在上述条件下每消耗2摩SO2气体时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com