
1.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是 ( )
A.Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds为金属元素
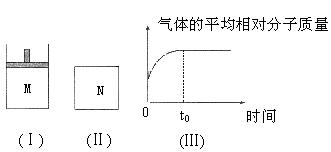
29.(6分)如图I,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为VL,发生如下反应并达到化学平衡状态:2
A(?)+B(?)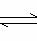 X C(g);△H<O平衡时A、B、C的物质的量之比为l∶3∶4,C的物质的量为y mol。
X C(g);△H<O平衡时A、B、C的物质的量之比为l∶3∶4,C的物质的量为y mol。
(1)根据题中数据计算,x=__ 、Y=__ ;
(2)如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
|
可能的 情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 (M表示摩尔质量) |
|
|
|
A |
B |
||
|
① |
是 |
不是 |
z=Y |
无法确定 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
28.(11分)污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)-CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2 H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)-CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
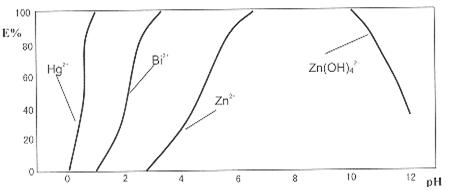
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)-CCl4络合萃取法处理废水。请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
27.(9分)已知2A2(g)+B2(g)  2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较a____________b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量ckJ,C3浓度________(填>、=、<)w mol/L,a、b、c之间满足何种关系__________________
(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是______。
a.v(C3)=2v(B2) ; b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出C3气体 ; b.适当升高温度;
c.增大B2的浓度; d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<),理由是
_____________________________。
2、下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。
 请回答下列问题:
请回答下列问题:
(1)写出C、D的结构简式:C ________, D ____________。
(2)指出反应②③所属的类型:② __________③ _________。
(3)写出下列反应的化学方程式:
① _____ ,
⑤ _____________________。
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性.一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是 。
1、乳酸 是人体生理活动的一种代谢产物,乳酸中是否存在对映异构体 ;乳酸分子中可能处于同一平面的原子数目最多为 种.
是人体生理活动的一种代谢产物,乳酸中是否存在对映异构体 ;乳酸分子中可能处于同一平面的原子数目最多为 种.
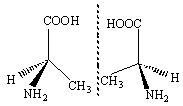
26.(12分)美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖.所谓手性分子是指在分子结构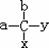 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。例如, 我们学过的普通氨基酸中丙氨酸(如图所示)即为手性分子,它有两种形状:(S)- 丙氨酸和 (R)- 丙氨酸, 它们互为镜像。不管我们如何旋转这些图形,都不能让他们互相重叠.这种现象称为对映异构。
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。例如, 我们学过的普通氨基酸中丙氨酸(如图所示)即为手性分子,它有两种形状:(S)- 丙氨酸和 (R)- 丙氨酸, 它们互为镜像。不管我们如何旋转这些图形,都不能让他们互相重叠.这种现象称为对映异构。
25.(6分)有下图所示的反应关系:A是中学化学中常见的无机物,A、B、C中含有同一种元素R,不含R的产物已略去。
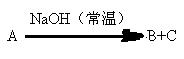
(1)若A与NaOH反应,既可只生成B,也可只生成C,还可以生成A+B。写出符合上述反应关系的A的两种不同类型物质的分子式:
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是(只写一种): ;R在A、B、C中的化合价必须满足的条件是: 。
24.茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500克干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6-7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果。
请回答下列问题:
(1)步骤1中,使茶叶灰化需要三角架、泥三角、酒精喷灯、 、 等仪器。
(2)步骤2中,判断沉淀已经洗涤干净的方法是 。
(3)步骤3中,滴定操作时,眼睛注视 。被滴定的20 mL滤液中CO32-的物质的量为__ _mol,原茶叶中钙离子的质量分数为___ _。
23.某金属单质与一定浓度的HNO3反应,假定只有单一的还原产物,当参加反应的单质与被还原的HNO3物质的量之比为2:1时,还原产物 ( )
A.NO2 B.NO C.N2O D.N2
卷Ⅱ(非选择题,共54分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com