
29.(12分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:

(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 。(填化学式)
(2)B的电子式为: 。
(3)写出反应②的化学方程式: 。
(4)写出反应⑤、⑥的离子方程式
⑤________________________________________ __________;
⑥_____________________________________ _____________。
28.(14分)短周期的六种元素A、B、C、X、Y、Z原子序数依次减小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外层上的电子数是它的电子层数的2倍,X和Z可形成XZ3的化合物;C与X处于同周期,B+和C2-的核外电子排布相同 A、B处于同周期,且形成BA型化合物。请回答:
⑴Y元素的名称是: C2-的离子结构示意图是为:
⑵A、B、C的离子半径由大到小的顺序为: (用离子符号表示)
⑶化合物XZ4A中所含有的化学键类型为: YZ4空间构型为
⑷元素组成为XZ5YC3和BCZ化合物的溶液之间反应的离子方程式: 。
(5)2.3克B在O2中充分燃烧,放出a kJ的热量( ),写出表示B燃烧的热化学方程式
。
),写出表示B燃烧的热化学方程式
。
27.(16分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、C1-、NH4+、Mg2+、Ba2+、CO32-、、SO42-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准状况下的体积) |
|
3 |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1-3判断混合物中一定不存在的离子是
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
(3)试确定K+是否存在? ,判断的理由是
。
26.(18分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
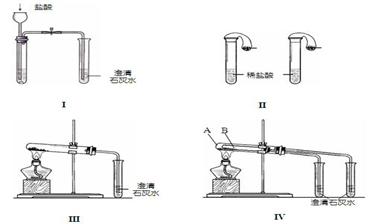
(1)只根据图I、II所示实验,能够达到实验目的是(填装置序号)__________________;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为 __________________
________、________________________________;与实验III相比,实验IV的优点是(填选项序号)___________________
A.IV比III复杂 B.IV比III安全
C.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是__________________;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为___________________,请设计实验检验所得溶液中溶质的阴离子。
_____________________________________________________________________。
13.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-==Fe3O4+S4O62-+2H2O下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
第II卷
注意:1.本卷共10题,共174分;
12.有下列物质:①石墨 ②铜丝 ③氧气 ④二氧化碳 ⑤食盐 ⑥硫酸 ⑦水 ⑧硫酸钡 ⑨金刚石,以下组合正确的是
A.能导电的有①②⑤⑦ B.属于电解质的有④⑤⑥⑦⑧
C.属于强电解质的有⑤⑧⑨ D.既不属于电解质又不属于非电解质的有①②③⑨
11.为验证浓硫酸与碳反应的气体产物中含SO2和CO2,通常是让气体通过适量品红溶液,然后通过足量KMnO4溶液,最后通过澄清石灰水,在这过程中SO2和CO2表现出的性质是
①SO2的漂白性; ②SO2的氧化性; ③SO2的还原性;
④SO2酸性氧化物; ⑤CO2酸性氧化物; ⑥CO2的氧化性。
A.①③⑤ B.①②④⑤ C.②③⑤⑥ D.①④⑤⑥
10.X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法正确的是
|
|
X |
|
Y |
|
Z |
|
W |
|
A.常压下,四种元素单质中,W单质的熔点最高
B.X的气态氢化物比Y的气态氢化物稳定
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的金属性比Z元素金属性强.
9.某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH溶液的物质的量浓度为
A.6.25mol/L B.12.5mol/L C.7mol/L D.7.5mol/L
8.运用元素周期律知识分析下面的推断,其中正确的是
A.锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱;
B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但溶于水也溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的固体
D.硒化氢(H2Se)是无色、有毒,比H2S更稳定的气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com