
4.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是( )
A.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末用右图装置进行实验,比较澄清石灰水是否变混浊
3.能正确表示下列反应的离子方程式是 ( )
A.向碳酸氢钙溶液中滴入过量澄清石灰水:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
C.硫酸镁溶液和氢氧化钡溶液反应SO42-+Ba2+=BaSO4↓
D.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O
2.设NA为阿伏加德罗常数,则下列说法中正确的是 ( )
A.78g Na2O2晶体中所含阴阳离子个数均为4NA
B.1.5gCH+3中含有的电子数为NA
C.3.4g氨中含有0.6NA个N-H键
D.11.2L氯气通入足量的氢氧化钠溶液中,转移的电子数目为0.5NA
1.下列实验操作或所记录的数据合理的是 ( )
A.NaOH溶液可保存在玻璃塞的试剂瓶中
B.硝酸要在带有玻璃塞的棕色试剂瓶中盛放
C.一学生用pH试纸测得某氯水的pH为2.5
D.配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉
31.把四氧化三铁现焦炭混合后隔绝空气加热,生成物分别可能为FeO、Fe,CO、CO2。
(1)写出四氧化三碳与碳反应生成物都是低价氧化物的化学反应式:
。
若按此反应进行还原1mol四氧化三铁,固体物质的质量减少 g.
(2)分别取116g四氧化三铁,加入足量的铁粉加热反应后产物分别如下表ABCD所列:
|
编号 |
产物 |
|
A |
FeO CO2 |
|
B |
FeO CO |
|
C |
Fe CO2 |
|
D |
Fe CO |
反应中生成气体在标准状况下的最大体积为 L,固体减少的质量最小为 g。
(3)与1mol四氧化三铁作用,从反应开始至反应结束消耗碳的质量mC的可能的范围为 。
(4)如果反应中产生的气体只有CO2,反应作用掉的碳的质量为Xg,则反应生成的固体产物m的取值范围为(用含X的函数表示) 。
(5)如果反应中生成的都是铁,测得反应产生的气体的密度折算到标准状况下为1.429g/L,反应中固体质量减小256g,则反应中生成铁的质量为多少?
30.为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1L水,设SO2完全被吸收,且溶液体积不改变。取出其中20.00mL溶液,加入2-3滴淀粉溶液后,用1.18×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,耗去19.07mL达到终点。(反应为SO2+I2+2H2O→H2SO4+2HI)求
(1)实验条件下碘的溶解度;
(2)该厂烟道气中SO2的含量(mg/L);
(3)为简便计算,在其余操作都不变的情况下,要使滴定时每水泵5mL碘水相当于烟道气中含SO21mg./L,则所配制的碘水的物质的量浓度为多少?
29.已知
从石油分馏产品C8H18制取二氢茉莉酮酸甲酯(香料)的流程如下:

试回答下列问题:
(1)有关反应的类型:① ,⑤ ,
(2)有关反应的条件:① ,② 。
(3)有关物质的结构简式:B ,D 。
(4)有关反应的化学方程式:
E→F ,
G→H 。
(5)B的同分异构体有很多,其中含四元碳环的位置异构共有 种,反应④可能产生的另一有机物的结构简式为 ,与该物质不同是同分异构体的是 ( )
A.丁二酸 B.乙二酸二甲酯 C.二乙二酸乙二酯 D.甲基丙二酸
28.根据①碳原子的电子层结构和每两个原子之间方能形成共用电子对而成为共价键;②烃分子中,每减少两个氢原子会减少两根碳氢键而增加一根碳碳键;③把一对共用电子对作为一根键,碳碳双键则为两根键……,苯环用凯库勒式作讨论,碳原子数用n表示。
(1)已知碳的一种同素异形体富勒烯C60。有六十个碳原子构成,则该物质分子中共有共用电子对数为 。
(2)那么烷烃CnH2n+2中含碳碳键 根,含共价键总数为 。
(3)炔烃中有共价键数 ,其发生某一反应后产物中含有共价键3n根,则发生的反应是 ( )
A.与H2 1:1加成 B.与氯气发生1:2加成
C.与H2P 1:1加成 D.一定数目分子加聚成环状化合物
(4)某烃分子中含有碳碳键数为n+3,则该烃可能为 ( )
A.环烷烃 B.稠环芳香径 C.苯及其同系物 D.二炔烃
27.重晶石矿的主要成分为硫酸钡,纯净的硫酸钡才能供医用作“钡餐”,在对某些内脏器官进行X射线透视时服用。硫化钡是可溶于水的盐。讨论用重日石矿制硫酸钡,设计流程如下:

(1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(2)为进行②反应先要分离出硫化钡溶液,采用的方法是 。在此之前要在溶液中滴入少量Ba(OH)2溶液,其作用是 。
(3)若B物质在该生产过程中可循环使用,则③反应的化学方程式是:
。
(4)有人提出②反应产生了有臭有毒的气体,可采用改变反应物的方法使无该气体产生,则②反应的化学方程式是: 。
此时若要B物质还能循环使用,则C为 (写化学式)。
(5)BaSO4是因为具有 、 等性质而可用作“钡餐”的。
26.化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中置一些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
乙组: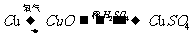
丙组:
丁组:
戊组: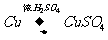
(1)甲组实验可用一个化学反应方程式表示为 ,使反应变快的可能原因是 。
(2)在五个方案中,科学性有错的是 组方案,经济性最差的是 组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用 组方案;②无污染,这应排除 组方案。
(4)相对能耗低,污染小的是 组方案。该给从反应器中排出的溶液中(含有少量H2SO4以抑制水解)取得产品的实验操作步骤应为 、 、
,对取得产品后残留物质的处理方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com