
3.下列有关说法正确的是 ................ ( )
A.在海轮外壳连接锌块可保护外壳不受腐蚀
B.电离、电化腐蚀均需在通电条件下才能进行
C.钢铁发生电化腐蚀时,正极反应为Fe-2e- = Fe2+
D.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
2.等物质的量的下列有机物在氧气中充分燃烧,消耗氧气最多的是 ( )
A.甲酸甲酯(HCOOCH3) B.乙醛
C.乙酸 D.乙醇
1.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷,悉尼奥运会火炬所用燃料为65%丁烷和35%丙烷,下列有关说法正确的是 ( )
A.丁烷的一氯代物有5种 B.丙烷和丁烷互为同系物
C.丙烷的熔沸点均高于丁烷 D.丙烷分子中三个碳原子在同一条直线上
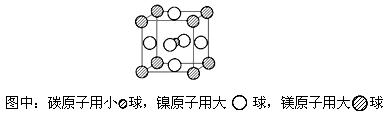
21.(12分)最近,由镁、镍和碳三种元素组成的化合物引起了科学家的注意。
(1)写出镍原子基态的电子排布式 。
(2)写出一氧化碳的结构式 ,
(3)四羰基镍[Ni(CO)4]为无色挥发性剧毒液体。熔点-25℃。沸点43℃。不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,呈四面体构型。四羰基镍的晶体类型是 ,镍原子和羰基之间的作用力为 。
(4)据报道,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(ccp)如图,试写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。
20.(10分)800℃时,在2L密闭容器内充入0.50molNO和0.25molO2 ,发生如下反应:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
|
t(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.50 |
0.35 |
0.28 |
0.25 |
0.25 |
0.25 |
(1)能说明该反应已达到平衡状态的是 。
A、v(NO2)正=v(O2)逆 B、容器内压强保持不变
C、v(NO)逆=2v(O2)正 D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A、适当升高温度 B、缩小反应容器的体积
C、增大O2的浓度 D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K。
(4)将上述反应进行到4s时的混合气体用足量的水吸收,为保证混合气体中NO、NO2全部转化为HNO3,计算还需通入的O2的体积(折算成标准状况)。
19.(12分)A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。

(1)根据分子结构模型写出A的结构简式 ___________
(2)拟从芳香烃 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
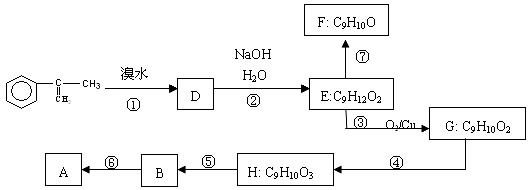
(a)写出⑤反应类型__________
(b)写出H的结构简式 ___________
(c)已知F分子中含有“-CH2OH”,通过F不能有效、顺利地获得B,其原因是 ________
__________________________________________________________________________
(d)写出反应方程式(注明必要的条件)
⑥ ________________________________________________________
⑦ __________________________________________________________
18.(10分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,阴极上的电极反应式为 ;
电解过程中,硫酸铜的浓度变化 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<<
1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100ml滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1。
17.(10分)海水中溶解了大量的气体物质和各种盐类。人类在陆地上发现的100多种元素,在海水中可以找到80多种。海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。
 回答下列问题:
回答下列问题:
 ⑴ 蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大。为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议 。
⑴ 蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大。为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议 。
 ⑵ 使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
⑵ 使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
 ⑶ 空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
⑶ 空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):

① 反应②的离子方程式为 ;
② 从反应③后的溶液中分离出单质溴的方法是 。
⑷ 苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有 。
16.
 (8分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期元素组成的单质中熔点最高的金属,K是一种气体。
(8分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期元素组成的单质中熔点最高的金属,K是一种气体。


 请填写下列空白:
请填写下列空白:
 (1)组成单质G的元素在周期表中的位置____________。
(1)组成单质G的元素在周期表中的位置____________。
 (2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
 (3)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是 (填写序号)。
(3)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是 (填写序号)。
 (4)反应④的离子方程式是:
。
(4)反应④的离子方程式是:
。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是: 。
15. (10分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
(10分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
指标 项目 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
 [观察外观]
[观察外观]
 该硫酸铵化肥无可见机械杂质。
该硫酸铵化肥无可见机械杂质。
 [实验探究]
[实验探究]
按下图所示装置进行实验。

 (1)烧瓶内发生反应的离子方程式为:
(1)烧瓶内发生反应的离子方程式为:
 烧杯中盛放的试剂最好是
(填“浓硫酸”、“稀硫酸”或“水”)
烧杯中盛放的试剂最好是
(填“浓硫酸”、“稀硫酸”或“水”)
 (2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是

 [交流讨论]
[交流讨论]
 甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
 乙同学:实验装置中还存在另一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
 经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
 [探究结论]
[探究结论]
 称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。得出探究结论为 。
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。得出探究结论为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com