
11.2007年10月25日我国第一颗绕月飞行的“嫦娥一号”火箭发射成功,火星上工作的探测车的任务之一就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在水。以下叙述正确的是 ( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶液解→过滤→向滤液滴加KSCN溶液
C.分别还原a molFe2O3所需H2、Al、CO的物质的量之比为2:3:2
D.明矾属硫酸盐,是纯净物
10.下列各离子浓度的大小比较,正确的是 ( )
A.同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>②
B.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH+4)>c(Cl-)
C.0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO-3)+c(H+)+c(H2CO3)
D.0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:
c(Cl-)>c(Na+)>c(NH+4)>c(OH-)>c(H+)
9.有关如下图所示装置的叙述不正确的是( )
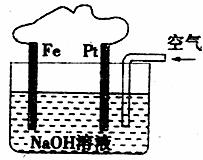
A.该装置内可发生原电池反应
B.该装置中Pt为正极,电极反应为:O2+2H2O+4e-=4OH-
C.该装置中Fe为阴极,电极反应为:Fe-2e-+2OH-=Fe(OH)2
D.溶液中会出现红褐色的沉淀
8.25℃,某未知浓度的氨水与pH=b的盐酸等体积混合,恰好完全反应。已知此氨水的密度为0.90g·cm-3,则该氨水质量分数为 ( )
A. B.
B. C.
C.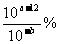 D.
D.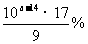
7.反应N2O4(g)  2NO2(g);△H=+57kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。下列说法正确的是
( )
2NO2(g);△H=+57kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。下列说法正确的是
( )

A.A、C两点的反应速率:A>C
B.B、C两点的反应速率:B=C
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的颜色:A深,C浅
6.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是 ( )
A.CO2的电子式 B.Cl-的结构示意图
B.Cl-的结构示意图
C.氧化钠的电子式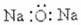 D.质量数为37的氯原子
D.质量数为37的氯原子 Cl
Cl
27.(10分)
(1)下列现象和应用与电子跃迁无关的是________。
A.激光 B.焰色反应 C.燃烧放热
D.原子光谱 E.霓虹灯 F.石墨导电
(2)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子。
① 某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键,_______个π键。
② 由A、B、C三种元素组成的无机阴离子,可形成二聚离子或多聚链状离子,从该阴离子的结构特点分析能够相互缔合的原因:
___________________________________________
_____________________________________________________________。
(3)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
C≡O |
357.7 |
798.9 |
1071.9 |
|
N≡N |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:____________________________________
_____________________________________________________________________。
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
① 基态28Ni原子的核外电子排布式为 __ ____ 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。
③ CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) ________________________ 。
26.(10分)
(1)相对分子质量不超过100的有机物X,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。X完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现X的氢谱如下:

① X的分子中含有的官能团名称是__________________________________。
② X的结构简式为___________________________________。
(2)请用合成反应流程图表示出由和其他无机物合成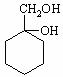 的方案:
的方案:
_________________________________________________________________________________
提示:① 合成过程中无机试剂任选;
② 合成反应流程图表示方法示例如下:
25.(9分)
丙烯和乙烯一样,都是重要的化工原料。由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)丙烯生成A和F的反应方程式分别为____________________________________、
__________________________ _______________。
(2)D生成E的反应是原子利用率100%的反应且D不能使溴的四氯化碳溶液褪色,则D的结构简式为_________ ______________。
(3)一定条件下,两分子E之间脱去一分子水生成一种具有芳香气味的物质。请写出反应的化学方程式_____________________________________________________。
(4)下列说法不正确的是__________。
A.丙烯没有同分异构体
B.聚丙烯能使酸性高锰酸钾溶液褪色
C.1 mol E与足量金属钠反应可以生成22.4 L氢气(标况)
D.化合物G属于酯类
24.(12分)
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:

① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器 编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(5)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若将24 g 炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为 kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com