
7.下列离子方程式书写不正确的是
A.往 溶液中滴加过量氨水:
溶液中滴加过量氨水: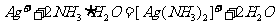
B.在硫酸铜溶液中加入氢氧化钡溶液:
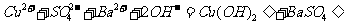
C.钠与水反应: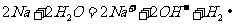
D.在碳酸氢钙溶液中加入少量的 溶液
溶液

6.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”。饮后可解“哑泉”之毒。经研究,“哑泉”水中溶有 ,“安乐泉”水质偏碱性。下列有关说法符合题意的是
,“安乐泉”水质偏碱性。下列有关说法符合题意的是
①“哑泉”之毒是由于水中的 使人体的蛋白质变性
使人体的蛋白质变性
②“哑泉”之毒是由于水中的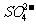 使人体中的蛋白质变性
使人体中的蛋白质变性
③“哑泉”之毒是由于水中的 水解显酸性使人体中的蛋白质变性
水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式万为
A.①④ B.②④ C.③ D.均不正确
23.(7分)硝酸是重要的化工原料。在硝酸工业生产中产生的尾气可用纯碱溶液吸收,有关的化学反应有(①式不完整,未配平);
NO2+NaCO3=NaNO2+ +CO2①
NO+NO2+Na2CO3=2NaNO2+CO2②
请按要求回答下列问题:
(1)①式中缺少的产物化学式为 ,其中氧化剂与还原剂物质的量之比为 。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需n(Na2CO3·10H2O)为 。
(3)现有1000g质量分数为21.2%的纯碱吸收液,在20℃用于吸收硝酸厂工业尾气。已知当产生22.4L(标准状况)CO2时,吸收液质量增加44g,求此时溶液中主要阴离子物质的量之比约为 。
22.(17分)欲制无水氯化铝并保存备用。现有仪器如下图所示,并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫酸等六种试剂。请回答下列问题:
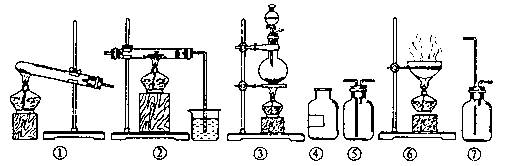
(1)设计的制取思路是: → →
(2)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(不一定填满)。
仪器编号: 、 、 、 、 ;
放入试剂: 、 、 、 、 。
(3)该实验中装置有不足之处,请指出
21.(10分)某校研究性学习小组设计了如图所示装置进行有关实验,实验时将分液漏斗中A逐滴加入烧瓶B中。(图中铁架台、铁夹已略去,要求填写的试剂均填化学式)

(1)若A为浓硫酸,B为第三周期金属元素的单质,其在常温下难与水反应;C为品红溶液,实验观察到C中溶液腿色,则B ,若使C试管溶液恢复原来的颜色,可采取的操作为 。
(2)若B为块状大理石,C为饱和Na2CO3溶液,实验中观察到C试管内溶液变浑浊,则C试管中发和反应的离子方程式为 。
(3)若B是生石灰,实验中观察到C溶液中先形成沉淀,而后沉淀溶解,当溶液恰好澄清时,关闭E,然后将C放入盛有沸水的烧杯中,静置片刻,观察到试管壁上出现光亮银镜。则A是 ,C是 与葡萄糖的混合液。仪器D在此实验中的作用是 。写出B中发生反应的方程式 。
20.(14分)下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子,Y为淡黄色固体。

(1)化学式:B为 ,F为 。
(2)用电子式表示D的形成过程为 。
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下同的选项序号) ;
a.直接与氧气发生化学腐蚀 b.通过原电池反应发生腐蚀 c.因溶于水而消耗掉。
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出正极的电极反应式:
(4)已知H为无色,密度比空气大的气体,则①中所涉及的反应的化学方程式为,
(5)写出F水溶液与足量Y反应的离子方程式: 。
19.(16分)有A、B、C、D、E六种元素,原子序数依次增大,位于不同的三个短周期,其中B与D可形成DB2、DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的元素符号
A C E
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为
(3)已知DB2在一定条件下可转化为DB3(g),1molDB2完全反应,放出98.3kJ的热量。该反应的热化学方程式是 ,工业上进行这一反应的设备是 ,反应的适宜条件为 。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为
;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。
若改用铁棒做阳极材料,则阳极的电极反应式为 。阴极反应式为 。
18.下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点越高
B.BaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.晶体熔化时,化学键不一定发生断裂
D.已知熔融条件下的反应:Fe2O3+3Na2O2 2Na2FeO4+Na2O,则234gNa2O2发生反应,转移了12mole-
2Na2FeO4+Na2O,则234gNa2O2发生反应,转移了12mole-
第Ⅱ卷(非选择题 共64分)
17.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是 ( )

A.CH3H2OH(气) B.CO和H2 C.CO D.H2
16.下列推断正确的是 ( )
A.根据同浓度的两元素含氧酸钠盐(正盐)溶液的碱性强弱,可判断该两元素非金属性的强弱
B.根据同主族两非金属元素氢化物沸点高低,可判断该两元素非金属性的强弱
C.根据相同条件下两主族金属单质与水反应的难易,可判断两元素金属性的强弱
D.根据两主族金属原子最外层电子数的多少,可判断两元素金属性的强弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com