
19.根据下图判断,下列说法正确的是 ( )

A.若反应Ⅰ中△H<0,则T2>T1 B.若反应Ⅰ中△H<0,则T2<T1
C.反应Ⅱ的平衡不受压强的影响 D.若反应Ⅱ中△H>0,则T2<T1
18.草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是 ( )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)=0.1mol/L
C.c(C2O42-)>c(H2C2O4)
D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
17.甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如图反应(反应条件省略),下列各组的甲、乙一定符合的是 ( )

A.钠和氢 B.氧和硫 C.碳和硅 D.铝和铁
16.如图所示,下列叙述正确的是 ( )

A.Y为阴极,发生还原反应 B.铜丝中没有电流产生
C.铜电极上有红色物质生成 D.Y与滤纸接触处变红
15.下列离子方程式书写正确的是 ( )
A.小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
14.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为: ( )

13.A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素x,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是: ( )
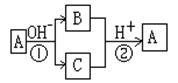
A.X元素可能为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
12.锂钒氧化物电池的能量密度远远超过其它材料电池,其成本低,便于大量推广,且对环境无污染。电池总反应式为V2O5+xLi==LixV2O5。下列说法不正确的是 ( )
A.正极材料为锂,负极材料为V2O5
B.向外供电时,锂离子在凝胶中向正极移动
C.正极的电极反应式为:xLi+ +V2O5 + xe-== LixV2O5
D.负极的电极反应式为:xLi-xe-==xLi+
11.已知pH=3的酸溶液和pH=11的碱溶液等体积混合后的溶液呈酸性,则发生的反应可能是 ( )
A.强碱和弱酸溶液之间的反应
B.强碱和强酸溶液之间的反应
C.浓度较大的酸和浓度较小的碱之间的反应
D.多元强酸和一元强碱之间的反应
10.下列实验过程能引起结果偏高的是 ( )
①配制100g10% CuSO4溶液,称取10g CuSO4晶体溶于90g水中
②测定CuSO4晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的硫酸溶液时,定容时俯视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液
⑤甲基橙做指示剂,标准NaOH滴定未知HCl时,红色变橙色为滴定终点
⑥酚酞为指示剂,未知NaOH溶液滴定标准HCl,如果NaOH溶液变质
A.①⑥ B.②④ C.②③ D.④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com