
10.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3 kJ/mol
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol
4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol
下列结论正确的是 ( )
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.稀硫酸与稀NaOH溶液反应的中和热△H=57.3 kJ/mol
C.碳的燃烧热大于110.5 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
9.五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是 ( )
①新制氯水久置后→浅黄绿色消失 ②无水CuSO4遇水显→蓝色
③溴化银见光分解→银白色 ④Na2CO3溶液中滴加酚酞→红色
⑤透过蓝色的钴玻璃观察钾盐的焰色→紫色⑥淀粉溶液遇单质碘→蓝色;
A.①②④⑤⑥ B.②③④⑤⑥ C.①②③④⑤ D.①③④⑤⑥
8.下图所示对实验仪器名称的标注或实验操作正确的是 ( )

7.2008年9月,奶粉中添加三聚氰胺事件再次敲响我国食品安全的警钟。三聚氰胺俗称蜜胺,是一种常用化工原料,由于其含氮量很高,所以一些不法商人在一些“宠物粮”甚至奶制品添加它以造成产品富含蛋白质的假象,其结构简式如图所示。下列有关三聚氰胺的说法正确的是 ( )

A.奶粉中添加三聚氰胺能提高蛋白质的含量,增加营养价值
B.三聚氰胺是一种白色结晶粉末,熔点高,硬度大,难溶于水
C.三聚氰胺分子式为C3N3(NH2)3,属于高分子化合物
D.三聚氰胺分子中含有氨基,氨基的电子式为 
16.(6分)燃烧法是测定有机化合物化学式的一种重要方法。完全燃烧0.1mol某烃后,测得生成的二氧化碳为8.96L(标准状况),生成的水为9.0g。据此请填空:
(1)此烃的化学式为____________;
(2)写出该烃可能有的同分异构体的结构简式________________________。
15.(8分)实验活动课上,学生从废旧干电池中回收碳棒、锌皮、二氧化锰、氯化铵、氯化锌等主要物质。
(1)二氧化锰的作用是与正极上的产物(H2)反应,生成Mn2O3,写出该反应的化学方程式:________________________________________________;
(2)得到氯化铵和氯化锌的晶体混合物后,检验其中含有 的方法是____________
____________________________________。
的方法是____________
____________________________________。
(3)学生将洗净的碳棒和锌皮堆放在一起晾干,一段时间后,发现锌皮上出现锈斑,用电极反应式阐明原因:____________________________________。
14.(6分)维生素C俗称抗坏血酸,常用于防治坏血病造成的血管破裂出血。为了了解维生素C的化学性质,我们将6片维生素C压碎,溶于10mL水中,然后过滤,取几毫升滤液,做下列实验:
(1)将滤液滴到蓝色石蕊试纸上,试纸呈红色;再用pH试纸测得维生素C溶液的pH在1和2之间。说明维生素C具有____________性;
(2)在CuSO4溶液中加入滤液并加热煮沸,发现有红色的铜析出。从氧化还原的角度说明维生素C具有____________性;
(3)把滤液加热煮沸5-10s,再重复做上述两个实验。发现维生素C的性质与未加热时的性质一样,即在100℃以下不会发生分解。这说明维生素C的性质比较___________________。
13.(12分)某地有一池塘,生长着丰富的水生植物和多种鱼虾,后来由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。据题意回答下列问题:
(1)从生态平衡角度看,池塘的这种变化说明了_________________________________;
(2)造成这种变化的原因是________________________________________________;
(3)经检测,污水中含有 的游离溴,可用亚硫酸钠除去污水中的溴,请写出化学方程式:________________________________________________;
的游离溴,可用亚硫酸钠除去污水中的溴,请写出化学方程式:________________________________________________;
(4)处理这种污水5L,需加入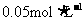 的亚硫酸钠溶液____________L才能将溴全部除去;
的亚硫酸钠溶液____________L才能将溴全部除去;
(5)要使池塘恢复原来的面貌,首先要解决的问题是________________________,首先要恢复的生物是____________________________________。
12.(10分)某学生进行如下图所示的Zn-Cu原电池实验。
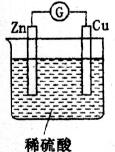
(1)从理论上讲,预期看到的现象是____________________________________;
(2)实验过程中,观察到锌极上有少量气泡逸出,铜极上产生大量气泡。试解释________________________________________________;
(3)锌片做____________极,铜片上发生的是____________(填“氧化”或“还原”)反应,电解质溶液pH____________(填“变大”、“减小”或“不变”)。
11.(8分)实验室可采用下列装置来测定某氨基酸的分子式:取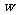 g氨基酸样品,放在纯氧中充分燃烧,生成二氧化碳、水和氮气。请回答下列问题:
g氨基酸样品,放在纯氧中充分燃烧,生成二氧化碳、水和氮气。请回答下列问题:
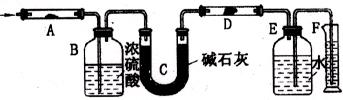
(1)E装置的作用是________________________________________________。
(2)需要加热的装置是____________(填字母);
(3)D的作用是________________________________________________;
(4)F处读数时应该注意________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com