
1.光纤通讯是70年代后期发展起来的一种新型通信技术,目前长距离光纤通讯系统已经投入使用。光纤通讯的光学纤维是由下列哪种物质经特殊工艺制成
A.石墨 B.二氧化硅 C.氧化镁 D.氧化铝
25.请观察下列化合物A-H的转换反应的关系图(图中副产物均未写出),A的相对分子质量比X大34.5,请填写:

(1)写出有机物的结构简式:A____________________;H____________________。
(2)写出反应类型:反应①____________________;反应⑧____________________。
(3)写出下列反应的化学方程式:
反应③________________________________________;
反应⑥________________________________________;
B生成高分子化合物的反应________________________________________。
24.(12分)化学在能源开发与利用中起着十分关键的作用,研究化学反应进行的方向和限度具有重要的意义。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),已知356g “可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6kJ的热量,则甲烷燃烧的热化学方程式可表示为:_____________________。
(2)某种燃料电池,一个极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导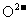 。已知该电池的正极的电极反应式为:
。已知该电池的正极的电极反应式为: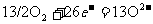 ,则该电池的负极的电极反应式为: __________,电池工作时,固体电解质里的
,则该电池的负极的电极反应式为: __________,电池工作时,固体电解质里的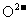 向电池的__________极移动。
向电池的__________极移动。
(3)已知NO2和N2O4可以相互转化: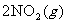

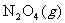 。现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
。现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
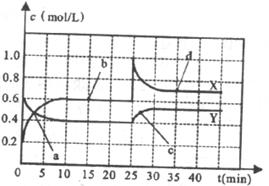
①请计算20min时反应的平衡常数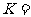 __________(用最简分式表示);前10min内N2O4的转化率为__________。
__________(用最简分式表示);前10min内N2O4的转化率为__________。
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________;反应进行至25min时,若只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是___________(用具体物质的数值、文字说明)。
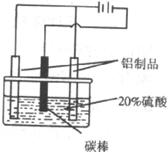
(4)为增强金属制品的抗蚀性能,需要对金属进行表面处理。如下图为铝的阳极氧化法表面处理技术原理示意图,可使铝制品表面生成一层致密的氧化铝膜(在特定条件下,生成的氧化膜不溶于稀硫酸)。阳极的电极反应式为:_________________;电解一段时间后溶液的pH__________(填“升高”、“不变”、“降低”)。
23.(8分)目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”。用添加有机盐、缓蚀剂和尿素的环保型融雪剂,可以减少对环境的危害。
(1)下列有关融雪剂的说法不正确的是__________(填序号)。
A.环保融雪剂可减少对植物的危害,且可给植物补充养分
B.融雪剂能够加快冰雪融化是因为提高了冰点
C.“氯盐”融雪剂能造成土壤硬化贫瘠,其原理与胶体聚沉有关
D.“氯盐”融雪剂的使用能加快路基上铁的腐蚀,其原理是形成原电池反应
(2)某研究性学习小组拟对融雪氯盐(主要含有氯化钠及不溶性杂质、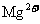 、
、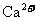 等)进行回收提纯研究。
等)进行回收提纯研究。
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
 |
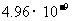 |
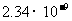 |
 |
该小组设计流程如下:

① 加入混合液A的主要成分是__________(填化学式)。
②为检验溶液B中的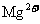 、
、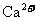 ,通常分别取少量溶液B于两支试管中,进行如下实验:
,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验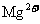 ,向其中一支试管中加入__________溶液(填化学式),看是否有沉淀生成。
,向其中一支试管中加入__________溶液(填化学式),看是否有沉淀生成。
步骤二:检验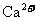 ,向另一支试管中加入某溶液,看是否有沉淀生成。下列三种溶液,其沉淀效果最好的是__________。
,向另一支试管中加入某溶液,看是否有沉淀生成。下列三种溶液,其沉淀效果最好的是__________。
A.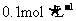 Na2CO3溶液 B.
Na2CO3溶液 B.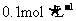 Na2SO3溶液
Na2SO3溶液
C.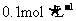 Na2C2O4溶液
Na2C2O4溶液
③在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12可确保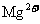 除尽,根据提供的数据计算,溶液B中
除尽,根据提供的数据计算,溶液B中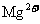 物质的量浓度将被控制在_________以下。
物质的量浓度将被控制在_________以下。
④对溶液B加热并不断滴加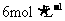 的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是____________________。
的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是____________________。
⑤溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热。
21.(6分)(1)实验室里不同化学试剂的保存方法不尽相同。下图中A、B、C、D是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内:
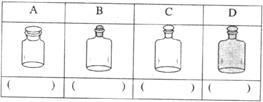
①NaOH溶液 ②浓硝酸 ③Na2CO3溶液 ④蓝矾 ⑤酒精 ⑥浓盐酸
(2)用试纸检验NaOH溶液pH大小的操作方法是______________________________。
20.(6分)多种物质的转化关系如下图所示(部分反应物或产物已略去):
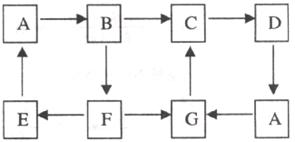
已知:①A、B、C、D、G含有同种元素,且它们的状态与颜色如下表:
|
物质 |
A单质 |
B溶液 |
C固体 |
D固体 |
G溶液 |
|
颜色 |
银白色 |
黄色 |
红褐色 |
红棕色 |
浅绿色 |
②E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,一种氧化物通入B溶液可被氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G。依据以上信息填空:
(1)写出物质的化学式D__________,F__________。
(2)写出下列反应的化学方程式,是离子反应的只写离子方程式
E→A_____________________; G与次氯酸反应_________________。
(3)选用提供的试剂,设计实验验证D中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为__________;证明含有FeO的实验现象为__________。
19.(5分)由短周期元素组成的A、B、C、D、E五种微粒,依次含有1-5个原子核,且每个微粒中都含有10个电子。其中只有C、D是分子,其余三种均是离子。已知五种微粒间有下列关系:
①B、E两种离子在加热条件下可生成C、D两种分子,通常状况下D为气态;
②向含A离子的溶液中加入D溶液,可生成白色沉淀W,D溶液过量沉淀也不消失,但再加入含大量B离子的溶液,沉淀W溶解。
(1)写出下列反应的离子方程式:W+含大量B离子的溶液:__________。
(2)五种微粒中的两种可与硫酸根形成一种复盐[复盐是指两种或两种以上的金属阳离子(或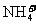 )与酸根离子所形成的盐],向该盐的浓溶液中逐滴加入浓苛性钠溶液,并不断振荡,产生的现象有:a.溶液中出现白色沉淀 b.有刺激性气味气体放出 c.沉淀逐渐增多d.沉淀完全消失 e.沉淀逐渐减少
)与酸根离子所形成的盐],向该盐的浓溶液中逐滴加入浓苛性钠溶液,并不断振荡,产生的现象有:a.溶液中出现白色沉淀 b.有刺激性气味气体放出 c.沉淀逐渐增多d.沉淀完全消失 e.沉淀逐渐减少
①上述各实验现象由先到后出现的正确顺序依次是(填写序号)__________。
②用相关的离子反应表示该溶液呈酸性的原因:____________________________。
18.在298K时,实验测得溶液中的反应: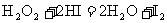 ,在不同浓度时的化学反应速率见下表,由此可推知当
,在不同浓度时的化学反应速率见下表,由此可推知当 ,
, 时的反应速率为
时的反应速率为
|
实验编号 |
1 |
2 |
3 |
4 |
5 |
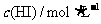 |
0.100 |
0.200 |
0.300 |
0.100 |
0.100 |
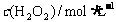 |
0.100 |
0.100 |
0.100 |
0.200 |
0.300 |
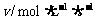 |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
0.0228 |
A.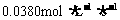 B.
B.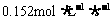
C.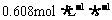 D.
D.
第Ⅱ卷(非选择题 共54分)
17.世界兴奋剂机构公布的《2008年禁用清单》违禁药物之一为甲异炔诺酮(tibolone),它的结构简式如下图。下列有关说法正确的是
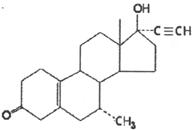
A.甲异炔诺酮中只含有羟基、碳碳叁键及羰基官能团
B.甲异炔诺酮分子的化学式为C21H28O2
C.1mol甲异炔诺酮在浓硫酸作用下脱去1mol水,所得产物有两种
D.1mol甲异炔诺酮与足量的氢气催化加成,最多消耗2molH2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com