
5.镁粉是制备焰火的原料,工业上通过冷却镁蒸气制得镁粉。下列气体中。可以用来冷却镁蒸气的是 ( )
A.空气 B.二氧化碳 C.氧气 D.氩气
4.可一次性鉴别氯化镁、氯化锌、碳酸钾等三种溶液的试剂是 ( )
A.Be(NO3)2溶液 B.AgNO3溶液
C.NaOH溶液 D.CH3COOH溶液
3.下列说法不正确的是 ( )
A.蛋白质水解的最终产物是氨基酸
B.米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质
C.油脂、乙醇是人体必需的营养物质
D.水果因含有酯类物质而具有香味
2.NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4L水中含有NA个H2O分子
B.14g NA含有的核外电子总数为14NA
C.1 mol乙烯分子含2NA个碳碳双键
D.2.3g金属钠与足量水反应时失去的电子数是0.1NA
1.下列说法与“节能减排”不相符的是 ( )
A.为推广氢能的使用,工业上可采用电解水法制取大量氢气
B.将石油裂化、裂解,综合利用石油资源
C.有节制地开采煤、石油、天然气等矿物资源
D.倡导“绿色化学”理念,逐步实现化工企业零排放
33.(8分)[化学-有机化学基础]
某有机物X(C12H12O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下:

已知X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。
① C的核磁共振氢谱只有一个吸收峰
② 室温下A经盐酸酸化可以得到苹果酸E,E的结构简式为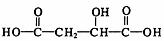
试回答:
(1)B中所含官能团的名称是 。
(2)C的结构简式为 。
(3)E不能发生的反应类型是 。(填序号)
a.加成反应 b.消去反应 c.氧化反应 d.酯化反应
(4)E的一种同分异构体F有如下特点:1 mol F可以和3mol金属钠发生反应,放出33.6L H2(标准状况下),1 mol F可以和足量NaHCO3溶液反应,生成1 mol CO2,1 mol F还可以发生银镜反应,生成2 mol Ag。试写出F可能的一种结构简式: 。
(5)在一定条件下两分子E可以反应生成六元环酯,写出此反应的化学方程式:
。
32.(8分)[化学-物质结构与性质]
(1)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65℃),甲醇的沸点明显高于甲醛的主要原因是 ;甲醛分子中C的杂化方式为 ,分子中共有 个π键。
(2)砷化镓属于第三代半导体,它能直接将电能转化为光能。已知砷化镓的晶胞结构如下图。是回答下列问题:

① 下列说法正确的是 (选填序号)
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷和镓都属于p区元素
② Ga的核外电子排布式为 ;
③ 砷化镓是将(CH3) 3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为 ;(CH3) 3Ga中碳镓键之间键角为 。
31.(8分)[化学-化学与技术]
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:

(1)投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为___________。
(2)步骤二中“连续搅拌”的目的是__________________________;
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4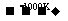 MnFe2O4-x+
MnFe2O4-x+ O2↑
O2↑
MnFe2O4-x+xH2O→MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
① 从理论上讲,该循环中,1 mol H2O能制 mol H2
② 若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为______。
③ 针对MnFe2O4热化学循环制氢过程存在的不足,你认为热化学循环制氢还需要解决的化学问题是 。
30.(16分)某化学课外活动小组在实验室做了如下一系列实验:
(1)该小组设计了如图所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性。
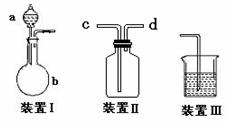
① 甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入 或 ,装置Ⅱ从 管口进气即可作为O2的收集装置。
② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
(2)小组在整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶。标签破损(如下图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出二种猜想,并设计实验验证,写出任一种的实验操作、现象和结论。
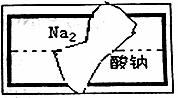
|
|
猜想物质的化学式 |
检验所需要的试剂 |
操作、现象和结论 |
|
① |
|
|
|
|
② |
|
|
|
(3)该小组从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol·L-1NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol·L-1的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液
d.滤液中注入2 mol·L-1的硫酸,使其pH保持为2……
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
|
pH |
1.5~3.2 |
6.4~8.0 |
① 步骤a中用pH试纸控制溶液pH=8,使用pH试纸的操作是 ;步骤b中如何检验沉淀已经洗涤干净? 。
② 要制得ZnSO4·7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐仪器是 。
[选做部分]
29.(12分)氮是地球上含有丰富的一种元素,氮及其化合物在农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。
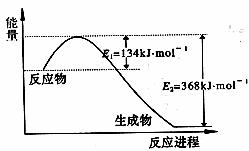
(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;又知:N2 (g)+2NO2 (g)=4NO(g)。
△H=+292.3kJ·mol-1,则反应:2NO(g)+2CO(g)  N2(g)+2CO2
(g)的△H为
;
N2(g)+2CO2
(g)的△H为
;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2 (g)+O2 (g)  2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
|
t(s) |
0 |
500 |
1000 |
1500 |
|
n(NO2)(mol) |
20 |
13.96 |
10.08 |
10.08 |
① 写出该反应的平衡常数表达式:K= ,已知: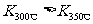 ,则该反应是 热反应;
,则该反应是 热反应;
② 反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2的转化率将 (填“增大”、“减小”、“不变”);
③ 下图中表示N2O5的浓度的变化曲线是 ,
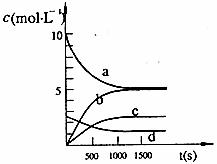
用O2表示从0~500s内该反应的平均速率v= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com