
7.下列叙述正确的是
A.原子晶体中各相邻原子之间都以共价键结合
B.分子晶体中都存在范德瓦耳斯力,分子内都存在共价键
C.HF、HCl、HBr、HI四种物质的沸点依次升高
D.干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型
6.化学与环境、生产和生活密切相关,下列说法与事实相符的是
A.空气中的SO2是造成光化学烟雾的主要原因
B.将草木灰和硫铵混合施用,肥效更高
C.棉花、蚕丝和锦纶的主要成分都是纤维素
D.推广使用可降解塑料,有助于减少“白色污染”
25.在50mLamol·L-1的硝酸溶液中,加入6.4gCu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)=3mol·L-1
(1)求稀释后的溶液pH 。
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH====2NaNO2+H2O
2NO2+2NaOH====NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH恰好被吸收,
求NaOH溶液的体积 mL?
24.(12分)N2在化工生产、农业、医疗、航天航空等诸多领域用途广泛。某化学兴趣小组同学为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。
[查阅资料]N2的制法有下列三种方案:
方案1:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉
方案2:加热NaNO2和NH4Cl的浓溶液制得N2。
方法3:将空气缓缓通过灼热的铜粉获得较纯的N2。
[实验准备]以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出。)

[分析交流]
(1)若按方案1制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套 制气装置按气流从左到右的顺序连接的顺序是(填写装置序号) ,获得N2的反应原理是(写化学方程式) 。
(2)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气收集,其原因是 , 你提出的收集方法是 。
(3)若以方案2制得N2,应选择的发生装置是(填装置序号) ,为使发生装置 能安全进行实验,可在烧瓶中先加入 。
(4)上述三个方案中,制得的N2纯度最低的是 。在N2纯度要求不甚严格的情 况下,有人建议将方案1和方案3结合使用,你认为其优点是 。
23.(10分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性 质。
[提出问题]Na2S2O3是否与Na2SO4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化
[实验探究]基本上述猜想①②,设计实验方案。
|
|
实验操作过程 |
实验现象或预 期实验现象 |
现象解释(用离子方程式表示) |
|
猜想① |
|
 溶液pH=8 溶液pH=8 |
|
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O32-+2H+===S↓+SO2↑+H2O |
|
|
猜想② |
向新制氯气(pH<2)中滴加少量Na2S2O3溶液 |
氯气颜色变浅 |
|
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似
[问题讨论]
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀, 并据此认为氯气可将Na2S2O3氧化。你认为该方案是否合理并说明理由 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3被氯气氧化 。
22.(10分)(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
|
实验编号 |
HA的物质的量浓度 (mol·L-1) |
NaOH的物质的量浓度 (mol·L-1) |
混合后溶液的pH |
|
甲 |
0.1 |
0.1 |
pH=a |
|
乙 |
0.12 |
0.1 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? 。
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中粒子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B====H++HB- HB-  H++
B2-
H++
B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+ c(HB-)=0.1mol/L B.c(B2-)+ c(HB-)+ c(H2B)=0.1mol/L
C.c(OH-)= c(H+)+ c(HB-) D.c(Na+)+c(OH)=c(H+)+c(HB-)
21.(10分)现有aA、bB、cC、dD、eE吴中短周期元素,A、B、C、D都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d;B、D都有同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中大多都含有A、B两种元素。E是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)写出下列元素的名称:B 、C 。
(2)写出工业上制取E的化学方程式 。
(3)在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,写 出该反应的离子方程式 。
(4)在A、B、D三种元素按照原子个数比4:1:1组成的化合物甲可与D单质构成燃 料电池,该电池用多孔的惰性电极侵入浓KOH溶液,两极分别通入化合物甲和D单质,写出电池的负极反应式: 。
20.(7分)
①CaCO3(s)=CaO(s)+CO2(g) △H=177.7kJ·mol-1
②C+H2O=CO+H2 △H=-131.3 kJ·mol-1
③2S(g)+O2 (g)=2SO2 (g) △H1=a kJ·mol-1
④2S(s)+O2 (g)=2SO2 (g) △H2=b kJ·mol-1
⑤CO(g)+ O2 (g)=CO2 (g) △H=-283
kJ·mol-1
O2 (g)=CO2 (g) △H=-283
kJ·mol-1
⑥C(s)+O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
⑦N2
(g)+3H2 (g)  2NH3(g) △H=-92.4
kJ·mol-1
2NH3(g) △H=-92.4
kJ·mol-1
(1)上述热化学方程式中明显不正确的有 (填序号,下同)
(2)上述反应中表示燃烧热的热化学方程式的有 。
(3)比较△H1 △H2(选填“=”、“>”、“<”=
(4)根据上述信息,写出C燃烧转化为CO气体的热化学方程式 。
(5)对于反应⑦,在恒温恒压的条件下,三个容器中分别充入的气体和反应的焓变 (△H)如下表所示
|
容器 |
N2(mol) |
H2(mol) |
Ne(mol) |
△H |
|
甲 |
1 |
3 |
0 |
△H1 |
|
乙 |
2 |
6 |
0 |
△H2 |
|
丙 |
2 |
6 |
1 |
△H3 |
根据以上数据,下列叙述正确的是 。
A.△H1=-92.4kJ.mol-1 B.△H2=△H3<△H1
C.△H1>△H3>△H2 D.△H2=2△H1<△H3
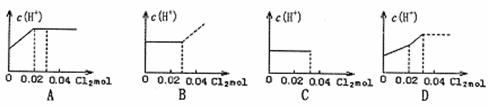
19.将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( )
第Ⅱ卷 (非选择题 共55分)
18.下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是 ( )

A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4LCl2,同时产生2molNaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com