
15.元素A的单质及A与B形成的化合物能按如下图所示的关系发生转化。则下列说法正确的是
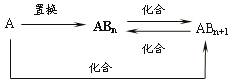
A.图中物质间的转化不都是氧化还原反应 B.当n=1时,A可能是N2
C.A一定是金属元素 D.当n=2时,A可能是Fe
14.500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法不正确的是
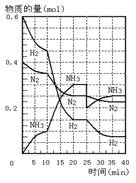
A.反应开始到第一次平衡时,N2的平均反应速率为 0.0075mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min时,分离出0.1mol的氨气
D.在25min时平衡正向移动,且达到新平衡后NH3的体积分数比原平衡大
13.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
D.N3-与CO2含相等电子数
12.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
11.NA代表阿伏加德罗常数,下列叙述错误的是
A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.同温下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量不同
10.下列离子方程式正确的是
A.过氧化钠和水反应:2O2- 2+2H2O=4OH-+O2↑
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
9.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3 ② 还原性:Cl->As ③ 每生成1molAs,反应中转移电子的物质的量为3mol ④ M为OH- ⑤ SnCl62-是氧化产物
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
8.向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
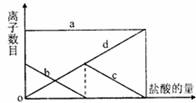
|
|
a |
b |
c |
d |
|
A |
Cl- |
K+ |
CO32- |
HCO3- |
|
B |
K+ |
CO32- |
Cl- |
HCO-3 |
|
C |
K+ |
CO32- |
HCO3- |
Cl- |
|
D |
K+ |
HCO3- |
Cl- |
CO32- |
7.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时,在正极上是Li+得电子被还原
D.放电时电池内部Li+ 向负极移动
6.在大试管内依次加入20 mL蒸馏水、10 mL无水酒精、7 g硫酸铵晶体,充分振荡后静置片刻,出现液体分层及部分固体沉淀的现象; 再用激光笔测试, 仅上层液体出现如图所示现象。依据上述描述,判断下列说法错误的是
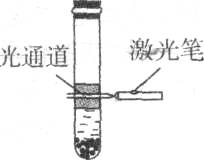
A.硫酸铵的溶解过程属于熵增的过程
B.上层可能是硫酸铵在乙醇中形成的胶体
C.该温度下,硫酸铵在水中的溶解度大于其在乙醇中的溶解度
D.再向该试管内滴入甲基橙试剂振荡后静置,上层液体显无色,下层液体出现红色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com