
28.有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
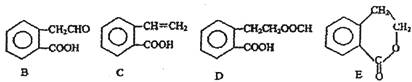
请回答下列问题:
(1)写出A中除苯环外具有官能团的名称 ;
(2)指出反应的类型:A→C: 。
(3)在A~E五种物质中,互为同分异构体的是 (填代号)。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与足量NaOH溶液供热的化学方程式: 。
27.某课外兴趣小组为了探究某种铝合金(合金元素为Mg)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计了下图装置进行实验。
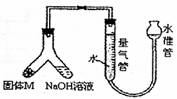
(1)在仪器组装完成后,加装试剂前必须要进行的操作是 。
(2)固体M与氢氧化钠溶液反应的离子方程式: 。
(3)倾斜Y管使氢氧化钠溶液(足量)与合金粉末(固体M)ag充分反应,待反应停 止后,进入量气管气体的体积VmL(已这算成标准状态)。若量气管最大量程为 50mL,则固体M的质量应 ;若a=38mg,V=44.8mL,该合金 (填 “符合”、“不符合”)国家标准。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积
(填“>”、“<”、“=”)
(5)另一兴趣小组利用该装置测定Mg的相对原子质量。需要直接测定的物理量为 ;
a.加入稀硫酸(浓度已知)的体积 b.镁条的质量 c.量气管读数
若测定结果偏小,可能的原因是 。
a.镁条表面氧化膜未除尽 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却即读取量气管读数 d.装置漏气
26.一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH) nCl6-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
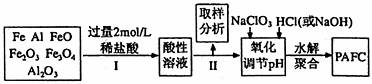
请回答下列问题:
(1)用10mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有 。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的是( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
|
(5)测定时所需的试剂有 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)测定时,直接测定的是 和 的质量(填化学式)。
(7)在测定过程中的操作顺序是:过滤、 、灼烧、 、称量。(写操作名称)。
25.一定条件下,在一个体积为10L的固定容器中发生反应:
N2
(g)+3H2 (g) 2NH3(g)+Q(Q>0),反应过程如下图:
2NH3(g)+Q(Q>0),反应过程如下图:
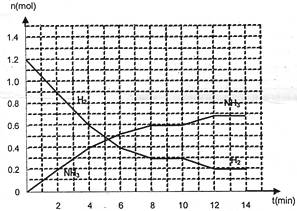
(1)写出该反应的平衡常数表达式K= ;K和反应物的平衡转化率都能表示可逆反应的进行程度。保持温度不变,增大H2的平衡转化率,则K值 (填编号)
a.增大 b.减小 c.不变 d.无法确定
(2)据上图,反应0~2min的v(N2)= mol/(L·min)。
(3)据图判断5min时,V正 V逆(填大于、小于、或等于,下同);10~12min间,V正 V逆,可能的原因 (填编号)
a.升高温度 b.增加H2 c.加入N2 d.移去NH3
(4)若在第10min时压缩容器体积,则平衡将 移动(填“向左”、“向右”或“不”)达到平衡时c(H2) 0.03mol/L(填“大于”、“小于”或“等于”)
24.现有七种物质PbO2、MnSO4、Pb(NO3) 2、PbSO4、HNO3、HMnO4、H2O组成一个化学方程式,已知PbO2等三种物质为反应物,PbSO4难溶于水
(1)写出反应的化学方程式,并配平化学方程式:
。
(2)反应中被氧化的是 元素,HNO3在反应中显示 性。
(3)把反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol/L,则反应中转移的电子数为 mol。
(4)根据上述反应中氧化剂的强弱状态,判断PbO2与浓盐酸的反应方程式正确的( )
A.PbO2+4HCl → PbCl4+2H2O B.PbO2+4HCl → PbCl2+2H2O+Cl2↑
C.PbO2+2HCl+2H+ → PbCl2+2H2O D.PbO2++2HCl → PbCl2+2OH-
23.下表是元素周期表的前三周期,用相应的化学用语回答下列问题:

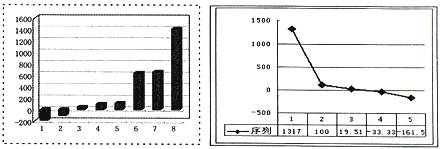
(1)第三周期8种元素按单质熔点(℃)大小顺序的示意图(上左图),其中序号“2”
代表 (填元素符号);序号“8”代表 (填符号),其原子的电子排布式为 。
(2)b、c、d、e、f的氢化物沸点直角坐标图(上右图),序号“1”的氢化物的电子式为 。
(3)a、d两元素可以形成一种含5原子的10电子微粒,该微粒中含有 化学
键,该微粒在水溶液中呈酸性的原因是(用离子方程式表示) 。
(4)元素f与元素g相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下g单质的颜色比f单质的颜色深
b.f的单质通入g的盐水溶液不能置换出单质g
c.f与g形成的化合物中g元素呈正价态
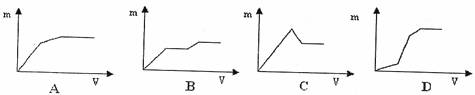
22.在含有4molHCl和1molMgSO4的混合溶液中逐滴加入Ba(OH) 2溶液,产生的沉淀质量m与加入Ba(OH) 2溶液体积V之间的关系,可能是下图中的(纵坐标表示沉淀的质量,横坐标表示氢氧化钡溶液的体积)( )
第Ⅱ卷 (共84分)
21.下列各项中的两个量,其比值一定为2:1的是( )
A.在反应2H2S+SO2→3S+2H2O中被氧化与被还原的硫原子的质量
B.相同温度下,0.2mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中的c(H+)
C.在密闭容器中,N2+3H2 2NH3达平衡时的c(NH3)与c(N2)
2NH3达平衡时的c(NH3)与c(N2)
D.Na2CO3晶体中Na+与CO32-离子个数比
20.对于0.1mol/L
CH3COOH溶液存在电离平衡:CH3COOH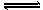 CH3COO-+H+-Q,下列说法正确的是( )
CH3COO-+H+-Q,下列说法正确的是( )
A.加水稀释或加入少量CH3COONa晶体时,CH3COOH电离程度变大
B.加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH值增大
C.升高温度或加水稀释,溶液中c(H+)/c(CH3COOH)值增大
D.加少量烧碱溶液或加少量冰醋酸,溶液中c(H+)/c(CH3COOH) 值增大
19.实验是化学研究的基础,关于下列各实验装置图的叙述中,不正确的是( )

A.装置①常用于分离互溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com