
13、下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )

A.向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中加入0.1 mol/L稀H2SO4溶液
B.向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中加入0.1mol/L NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向Ca(OH)2溶液中逐渐通入二氧化碳
12、已知 的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有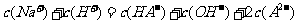
D.在Na2A溶液中一定有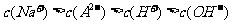
11、在一密闭容器中通入A、C、D各为2mol和xmolB,按下式发生反应:
A(g)+4B 2C(g)+D(g);
2C(g)+D(g); 达到平衡,下列说法错误的是( )
达到平衡,下列说法错误的是( )
A.若容器容积可变,且保持温度和压强不变,A、B、C、D的物质的量均加倍或减半,平衡不移动
B.若容器的容积可变,且保持温度和压强不变,A、B、C、D的物质的量均增加1mol,平衡一定右移
C.若容器的容积可变,且保持压强不变,降低温度时,容器的容积可能变大
D.若容器的容积固定,且通过调节温度使反应达到平衡时保持容器中气体总物质的量为10mol,当起始反应正方向进行时,x的取值范围是
10、有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列有关叙述中,正确的是( )
A.金属锂作电池的正极,石墨作电池的负极
B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
9、在AlCl3和FeCl3混合液中,先加入过量的KI溶液,再加入足量的Na2S,所得到的沉淀物是( )
A.Fe(OH)3、Al(OH)3 B.Al(OH)3、I2
C.Fe2S3、I2 D.FeS、S、Al(OH)3
8、下列关于元素的叙述正确的是( )
A.非金属元素间不可能形成离子化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有32种元素
D.目前使用的元素周期表中,包含元素种类最多的族为VIA
7、表示下列各反应的离子方程式,不正确的是( )
A.铁溶于足量的稀硝酸:Fe+4H++NO3-===Fe3++NO↑+2H2O
B.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-====Mg(OH)2↓+2CaCO3↓+2H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32-+H2O===2NaHCO3↓
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
6、阿伏加德罗常数约为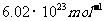 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
A.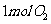 参加反应,一定得
参加反应,一定得 个电子
个电子
B.7.5g SiO2晶体中含有硅氧键数为
C.2.24L CH4中含有的原子数为
D.250mL 2mol/L的氨水中含有NH3·H2O的分子数为
20.(B).(化学--有机化学基础,13分)
有机物 遇FeCl
遇FeCl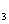 ,溶液显紫色,其部分结构简式如下
,溶液显紫色,其部分结构简式如下
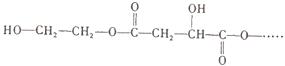
已知加热X与足量的NaOH水溶液充分反应后,经盐酸酸化得到A、B、C三种有机物,其中C分子含碳原子最多。B的核磁共振氢谱出现两组峰。A与B有如下转化关系。

提示:RCH=CHR’在酸性高锰酸钾溶液中反应生成RCOOH和R’COOH
请回答:
(1)写出A含有的官能团的名称__________________________________.
(2)写出A-D的反应类型:_____________________________
(3)写出物质B在铜作催化剂,加热条件下与E反应的化学方程式
_________________________________________________________________________
(4)若C烃基上一氯代物只有一种,则C的结构简式为
________________________________________________________________________
|
(6)写出高分子G的结构简式__________________________________.
20.(A).(化学--物质结构与性质,13分)
A、B、C、D、E五种元素,A元素的周期数、主族数、原子序数相同;B的基态原子核外有3种能量不同的原子轨道,且每种轨道中的电子数相同;C元素的电离能如下图所示;D元素的价电子构型为 ;E是第4周期的过渡金属元素,血红蛋白中的E元素与BD形成的配位键比与D:形成的配位键强。E单质与BD形成的配合物E(BD)
;E是第4周期的过渡金属元素,血红蛋白中的E元素与BD形成的配位键比与D:形成的配位键强。E单质与BD形成的配合物E(BD) ,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。
,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。

(1)E(BD) 晶体属于______________(填晶体类型)。
晶体属于______________(填晶体类型)。
(2)A元素和B元素组成的化合物分子之间 ___________(填“有”或“没有”)形成氢键。
(3)基态E原子的电子排布式为 __________________________。
(4)B、C、D三种元素的电负性由大到小的顺序是______________(填元素符号)。
(5)C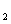 和B
和B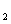 A
A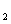 的分子中根据电子云重叠的方式不同,都包含的共价键类型有______。
的分子中根据电子云重叠的方式不同,都包含的共价键类型有______。
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似。根据下表数据,说明BD分子比C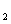 分子活泼的原因__________________________________
分子活泼的原因__________________________________
|
|
X-Y |
X=Y |
X Y Y |
|
BD的键能(KJ·mol-1) |
357.7 |
798.9 |
1071.9 |
C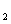 的键能(KJ·mol-1) 的键能(KJ·mol-1) |
154.8 |
418.4 |
941.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com