
6.下列有关指定实验装置图的说法不正确的是 ( )
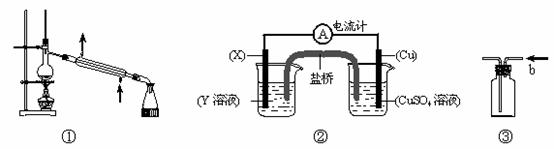
A.装置①可用于除去水等液体中混有的难挥发或不挥发的杂质
B.装置②中的Cu一定作正极
C.当装置②电路中通过2mol电子时,Cu电极可能增重64g,也可能减重64g
D.当装置③广口瓶中充满了CO2,b口进气可收集NO气体
5.下列叙述正确的是 ( )
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2]=1∶1时,HCO3-完全转化为CaCO3
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2]=1∶1时,能得到澄清溶液
C.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=1∶1时,铝元素以AlO2-形式存在
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶1时,溶液中铁元素只以Fe3+形式存在
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.足量的铜片与含4 mol HNO3的浓硝酸充分反应生成二氧化氮的分子数为2NA
B.14g链烃(分子通式为CnH2n≥2)中含有的C=C的数目一定为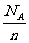
C.若某醋酸钠溶液中含有1mol CH3COO-,则Na+数目等于NA
D.O2和N2的混合气体22.4L中一定含有2NA个原子
3.下列各组离子一定能大量共存的是 ( )
A.含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+ D.pH=7的溶液:Fe3+、Mg2+、SO42-、Cl-
2.下列化学实验或操作能够达到目的的是 ( )
A.欲除去蛋白质溶液中的NaCl而又不改变它的性质,可加入适量BaCl2溶液,再过滤
B.将溴乙烷和NaOH溶液共热后,再滴加AgNO3溶液可检验其中的溴元素
C.为除去含有Mg(OH)2和Ca(OH)2的浊液中的Ca(OH)2,可向其中加入足量MgCl2,充分反应后,过滤
D.除去乙酸乙酯中混有少量乙酸:加入乙醇和浓硫酸,加热、静置、分液
1.下列说法中不正确的是 ( )
A.三聚氰胺与盐酸和硫酸等都能形成三聚氰胺盐
B.三聚氰胺含氮的质量分数高于尿素
C.三聚氰胺分子中所有的氮原子化学环境均相同
D.三聚氰胺甲醛树脂是一种高分子材料
29、(13分)Cu-Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),现进行如下实验(以下气体体积均在标况下测得):
①将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为VmL,过滤得绿色溶液A(不含Cu2+),还有滤渣B。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2混合气体896mL,经测定(标况下)此混合气体密度为1.52g/L。
③将①中所得滤液加入到同浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mLO2,气体恰好完全溶于水。
(1)过滤时,应用到的玻璃仪器有_______________________________
(2)A中的金属阳离子有______________,滤渣B中含______________________
(3)被腐蚀前的合金中Fe的物质的量为_______mo1,Cu的物质的量为_____mo1。
28、I、(14分)铜器长期暴露在潮湿空气中,它的表层往往含有“铜绿”(碱式碳酸铜),它受热易分解,为了从铜绿中制得铜,并测定铜绿在混合物中的质量分数,把铜绿样品放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如图1,请回答下列有关问题。
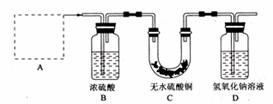 图1
图1
(1)A处应选用图2装置中的(填写编号) (铁架台已省去),选用的理由是① ;②通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净。

(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和______ _______;反应进行时,应先 再 ;实验过程中,观察到试管中固体颜色变化为 。
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量。
(4)为使实验更准确,可采取的措施是 。
II、(7分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大小”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 (填序号)。
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
27、(14分)A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如下图所示的转化关系:

(1)上述转化过程中包含的反应类型有 (填序号)
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
(2)在反应②中,阳极的电极反应方程式为
(3)乙在甲中燃烧,当有1mol电子转移,生成液态A时,放出142.9kJ的热量,则该反应的热化学方程式为
(4)反应③在一定条件下为可逆反应,若将3mol甲和4molC混合充入2L的密闭容器中,2min后达到平衡。平衡后混合气体的总物质的量为6mol,则甲的反应速率为 ,该平衡混合气体溶于水,恰好完全被水吸收,该反应的总化学方程式为 。
(5)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将气体B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式:
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为 。
26、(12分)A、B、C、D、E为短周期元素,A到E原子序数依次增大,质子数之和为40;B、C同周期;A、D同主族;A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为 。
(2)将D的单质投入A2C中,反应后得一种无色溶液,E的单质在该无色溶液中反应的离子方程式为 。
(3)A、C两元素可组成10电子粒子X-。Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为 。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述的目的,又保护了环境,试写出反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com