
16.(8分)已知A、B、E是常见的非金属单质,其中A为淡黄色固体,Y是常见的金属单质,C的相对分子质量比A大32,D、G均是重要的工业产品,Y、F、H、I均含有同种元素。X含有两种元素,具有摇篮形的分子结构,球棍模型如图所示。H为红褐色沉淀。图中部分反应条件和产物已略去。


试回答下列问题
(1)写出X的化学式:______________。
(2)写出G的电子式:_____________。
(3)写出反应③的化学方程式_______________________________________。
(4)写出C和I溶液反应生成F的离子方程式_________________________________。
15.(10分)硫是煤中的有害成分。艾士卡法是世界公认的测定煤中硫含量的标准方法。
原理:将煤样与艾氏卡试剂(简称艾氏剂)混合灼烧,煤中的硫全部转化为硫酸盐,然后以BaCl2为沉淀剂使硫酸根离子转化为硫酸钡沉淀。根据硫酸钡的质量计算煤样中硫的含量。艾氏剂是质量比为2∶1的轻质MgO与无水Na2CO3的混合物。
实验步骤:
①称取粉碎的干燥煤样1.00g和艾氏剂2g置于30mL的瓷坩埚中,充分混匀,再用1g艾氏剂覆盖。高温加热1-2h。
②取出坩埚,冷却到室温,将灼烧物放入烧杯中,用热蒸馏水冲洗坩埚内壁,将冲洗液加入烧杯中,再加入100-150mL 煮沸的蒸馏水,充分搅拌。
③过滤,用热蒸馏水冲洗烧杯3次,冲洗液加入过滤器。再用热蒸馏水清洗残渣至少10次。
④在上述滤液中滴加盐酸溶液,使溶液呈微酸性。将溶液加热至沸腾,在不断搅拌下滴入BaCl2溶液l0mL,在近沸腾状况下保持2h。
⑤将溶液与其中沉淀放置过夜后,经过滤、洗涤、干燥后称量,得沉淀m1g。
⑥艾氏剂应进行空白实验(实验除不加煤样外,全部按步骤①~⑤进行,目的是排除其他含硫物质的干扰),得到沉淀质量为m2g。
根据以上知识回答下列问题:
(1)写出煤中燃烧产生的二氧化硫被艾氏剂中的Na2CO3吸收生成硫酸盐的化学方程式___ _。
(2)如果步骤③中残渣清洗不充分,实验结果将________________。如果步骤④中用硫酸代替盐酸,实验结果将________________(均填“偏大”、“偏小”或“无影响”)
(3)步骤④在滤液中滴加盐酸使溶液呈微酸性的目的是_____________________。
(4)如何用实验证明步骤⑤中的沉淀已洗净?_____________________________
__________________________________________________________________ 。
(5)用上述实验数据(包括字母)表示出该煤样中硫元素质量分数_______。
14.白云石的化学式是xCaCO3·yMgCO3。可用于制取耐火材料等,优质的白云石粉可作为昂贵的二氧化钛填料的替代品。现称取27.6g白云石,加热到质量不再变化,收集到的CO2为6.72L(已换算成标准状况)。下列有关说法正确的是 ( )
A.白云石的化学式为2CaCO3·MgCO3
B.残留固体的质量为14.4g
C.取13.8g该白云石与足量盐酸完全反应,最多收集到标准状况下的CO 22.24L
D.27.6g白云石与过量盐酸完全反应,可消耗HCl 0.3mol
非选择题
13.肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是 ( )
A.负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑
B.正极的电极反应式是:O2+4H++4e-=2H2O
C.溶液中阴离子向正极移动
D.溶液中阴离子物质的量基本不变
12.下列实验方法不正确的是 ( )
A.将MgCl2•6H2O在HCl气流中加热可制得无水MgCl2
B.用品红溶液可以鉴别乙醛、苯、硝基苯
C.用碱式滴定管量取10.00mL1mol·L-1的KMnO4溶液
D.用瓷坩埚灼烧氢氧化钠或碳酸钠固体
11.下列溶液中各微粒的浓度关系或说法正确的是 ( )
A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、
④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
10.香叶醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成。

下列有关说法中正确的是 ( )
A.反应①②③均为取代反应
|
C.香叶醇和橙花醇具有相同的分子式
D.乙酸橙花酯可以发生取代、加成、氧化和聚合反应
9.下列离子方程式中正确的是 ( )
A.向 NaHS 溶液中通入少量氯气:HS―+Cl2=S↓+H++2Cl-
B.向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.Na2CO3溶液呈碱性的原因:CO32-+H2O HCO3-+OH-
HCO3-+OH-
D.用FeS除去工业废水中的Hg2+:Hg2++S2-=HgS↓
8.下图表示反应N2(g)+3H2(g) == 2NH3 (g);△H﹤0在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是( )
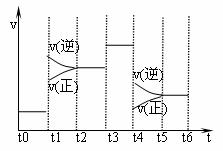
A.氨气的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段氨气的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动
不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
7.下列排列的顺序正确的是 ( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③碱性:Mg(OH)2>Al(OH)3>LiOH
④结合质子能力:CO32->HCO3->SO42-
A.①③ B.②④ C.①④ D.②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com