
32.(8分)[化学--物质结构与性质]
氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着
个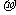 键和
个
键和
个 键;
键;
(3)磷、氮、氧是周期表中相邻的三种元素,比较:
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;
②N2分子中氮氮键的键长 (填“大于”、“小于”或“等于”)白磷分子中磷磷键的键长;
(4)氮元素的氢化物--NH3是一种易液化的气体,氨分子中氮原子杂化类型为
杂化,该气体易液化的原因是 。
31.(8分)[化学--化学与技术]
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产了纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特旬原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
第二同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
30.(16分)下图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择。

(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、 。
②检查好装置的气密性后加热B前必须进行的操作是 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
①各仪器装置按气流方向从左到右连接顺序A→C→B→C,请写出B中氨的催化氧化反应方程式 。
②装置B中可能观察到的现象是 。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。
①若SO2与过氧化钠反应生成O2,则反应的方程式可能为: ;
②根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):
A→( )→( )→( ),装置B中可能观察到的现象是 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(12分)海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消互液仅含一种溶质,写出该电解的化学方程式: 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为 ,控制溶液的pH为 。
28.(14分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原了半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
,用离子方程式表示X溶液呈酸性的原因是 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体已知[n(A):n(B)=3:1],可以放出18.44kJ热量,则该反应的热化学方程式为 。
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为 。
(5)在10L的密闭容器中,通入2molFC2气体和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为 。
15.一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01mol/L的NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的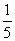 ,则样品中铁、铝的物质的量之比为 ( )
,则样品中铁、铝的物质的量之比为 ( )
A.2:3 B.1:3 C.1:4 D.5:3
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.为检验某溶液中的离子,进行了如下图所示的实验操作,过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是 ( )
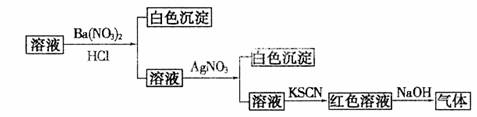
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
13.常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后(若混合后两者的体积可以相加),恰好完全反应,则下列有关所得混合液的说法正确的是 ( )
A.所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH)-
B.混合后溶液pH=7
C.所得混合液中存在c(CH3COOH)+c(CH3COO-)=0.05mol/L
D.混合后溶液中存在c(CH3COOH)+c(CH3COO-)=c(Na+)+c(H+)
11.下列离子方程式书写正确的是 ( )
A.澄清石灰水中加入盐酸:Ca(OH)2+2H+=2H2O+Ca2+
B.硫酸氢钠溶液中逐滴加入氢氧化钠溶液,至溶液恰好呈中性:
Ba2++OH-+SO42-+H+=BaSO4↓+H2O
C.少量Cl2通入FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
D.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
|
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
10.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,20gD2O和足量的金属钠反应产生气体的分子数为0.5NA
B.1molCl2参加的作何反应,反应过程中转移电子数都是2NA
C.14g乙烯和丙烯的混合物中所含原子数为1.5NA
D.1L0.5mol·L-1CH3COONa溶液中所含CH3COO-个数为0.5NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com