
11.下列说法中,不正确的是
A.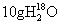 与
与 所含中子数相等
所含中子数相等
B.等物质的量的甲基(- )与羟基(-
)与羟基(-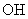 )所含质子数相等
)所含质子数相等
C.等物质的量的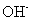 与
与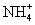 所含电子数与质子数均相等
所含电子数与质子数均相等
D.标准状况下,以任意比例混合的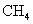 和
和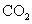 混合物22.4L,含有的分子数为
混合物22.4L,含有的分子数为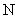
10.下列除去杂质的方法正确的是
①除去乙烷少量的乙烯:光照条件下通入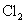 ,气液分离
,气液分离
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去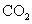 中少量的
中少量的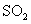 :气体通过盛饱和碳酸钠溶液的洗气瓶
:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
A.①② B.③④ C.②④ D.②③
9.生活是化学的源泉,下列有关生活中的化学叙述不正确的是
A.铁强化酱油可通过膳食补充人体所需的铁元素
B.不可用铝制餐具长时间存放酸性、碱性食物
C.一定浓度的双氧水可用于伤口的消毒
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
22.(8分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
(1)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
(2)“速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%。该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10%即不能再服用。为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000 mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL。通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应)
20.(8分)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:① 、②H-O-O-H。式中O→O表示配位键,即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂)。
、②H-O-O-H。式中O→O表示配位键,即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂)。
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a、将C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水;
b、将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c、将生成的A与H2反应(已知该反应中H2作还原剂)。
(1)用电子式表示②的结构: _____________。
(2)如果H2O2的结构如①所示,实验c中化学反应方程式为(A写结构简式,下同)
____________________________________________________;
假如H2O2的结构如②所示,实验c中化学反应方程式为 __ __。
(3)为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:________________________________________________________
21(14分)A、B、C、X均为中学常见的物质,它们之间有如下转化关系(副产物已略去)。
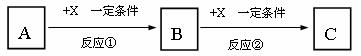
试回答:
(1)若X是强氧化性单质,则A不可能是_______________。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为________________。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(离子方程式表示)
(4)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B, X的化学式可能为(写出不同类物质)_________或_________,写出反应①的可能离子方程式 或
19.(12分)有机物A(C10H20O2)具有香味,可用作香皂、洗发香波等。已知:
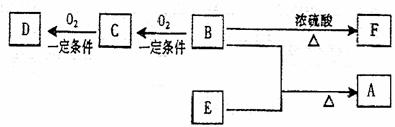
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应类型有 (选填序号)
①取代反应 ②消去反应
③加聚反应 ④氧化反应
(2)C、F分子所含的官能团的名称依次是: 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
。
(4)写出由B生成F的化学方程式 。
(5)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是
。
18.(12分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
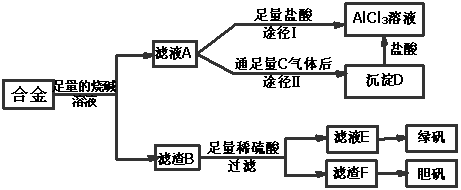
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和玻璃棒,还要补充的玻璃仪器是 。
(2)如何用实验证明沉淀D已洗涤干净________________________________。
(3)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 (填写途径Ⅰ或Ⅱ);请写出途径Ⅱ得到沉淀D的离子方程式_______________________。
(4)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩、 、过滤。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,但前者的方案更合理,理由是_________
A.后者消耗的酸和碱更多 B.后者难以实现物质分离
C.前者制得的产物更纯净 D.前者操作步骤更少,方案简单
17.(8分)请按要求填空:
(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质)______________;
②容量瓶 。
(2)当NaHCO3溶液中混有Na2CO3,为除去Na2CO3可以通入__________,化学方程式为 。
16.把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是
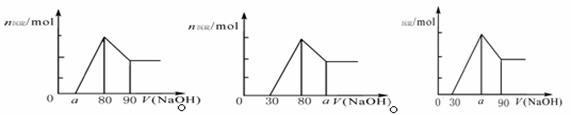
图A 图B 图C
A. 的取值范围为 0≤a<50
的取值范围为 0≤a<50
B. 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则 的取值范围为80<a<90
的取值范围为80<a<90
D.若将关系图改为C图时,则 的取值范围为75<a<90
的取值范围为75<a<90
第Ⅱ卷(非选择题 共62分)
15.2009年是中国农历牛年,有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是
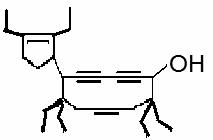
A.牛式二烯炔醇含有3种官能团
B.牛式二烯炔醇分子内能发生消去反应
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇含有3个手性碳原子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com