
30.(14分)化学科研小组的同学在测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验进一步探究,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L-1的H2SO3溶液的pH约为2。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol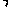 L-1的H2S溶液的pH约为4。
L-1的H2S溶液的pH约为4。
[实验操作]①准确称取纯净的Na2SO3·7 H2O晶体25.2 g,配成1L水溶液,测得其pH约为8。
②用坩埚再次准确称取25.2 g上述晶体,继而隔绝空气在6000C以上高温下强热至恒重,固体质量为12.6 g。
③将②所得12.6 g固体进行元素定性定量分析,其组成与Na2SO3完全相同。将其溶于水配成250 mL溶液,测得pH约为1l。
[分析猜想]Na2SO3·7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)在测定溶液pH的实验操作过程中,下列做法正确的是 (填字母代号)
a.先将pH试纸湿润后,再用玻璃棒蘸取待测液点到pH试纸上
b.直接将pH试纸插入待测液中
c.用玻璃棒蘸取待测液点到pH试纸上
d.先将pH试纸用蒸馏水粘到玻璃片上,再用玻璃棒蘸取待测液点到pH试纸上
(2)给Na2SO3·7H2O加热时要隔绝空气,请用简要的文字和化学方程式给以说明:
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是:
(不必配平)。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是 ,实验③中溶液的pH约为11的原理是(以相关的离子方程式表示) 。
(5)请你设计简单的实验方案,以验证你的猜想(请简要写出实验步骤、现象和结论):
[选做部分]
共5小题。考生从中选择2个物理、1个化学和1个生物题目作答。
29.(15分)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛。
(1)钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,使其表面形成一层四氧化三铁的技术过程。其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到1300C反应。其过程可以用如下化学方程式表示:
I.3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
II.6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3+7NaOH↑
Ⅲ.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①反应II中的氧化剂是 。整个反应过程中每有16.8g Fe参加反应转移的电子数为 NA。
②上述反应过程中会产生大量NH3。下列对NH3处理方案中合理的是 (填字母代号)
a.高空排放 b.用H2SO4吸收制氮肥 c.用于制备HNO3
(2)研究金属活动性顺序可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序及该反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序为_________________________。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
实验方案及现象:
(3)如下图,横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5 mol·L-1时,可认为沉淀完全)。试回答下列问题
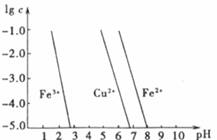
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol·L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
②从图中数据计算可得Fe(OH)2的溶度积Ksp [Fe(OH)2] 。
28.(13分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A元素原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,A、B、C三种元素都能与D元素形成两种或两种以上原子个数比不相同的常见化合物。E为常见金属元素,它与同主族下一周期元素的原子序数之差为18。试回答下列问题:
(1)均由A、C、D三种元素组成的不同类别的三种常见物质,当它们的水溶液浓度相同时,由水电离出的c(H+)由小到大的顺序为(填化学式): 。
(2)A与D可形成负一价双原子阴离子,请写出E的单质与过量该阴离子的水溶液反应的离子方程式 。
(3)设反应①Fe(s)+BD2(g) FeD(s)+BD(g) △H1其平衡常数为K1。
FeD(s)+BD(g) △H1其平衡常数为K1。
反应②Fe(s)+A2D(g) FeD(s)+A2(g) △H2,其平衡常数为K2 。
FeD(s)+A2(g) △H2,其平衡常数为K2 。
在不同温度下,K1、K2的值如下:
|
温度 |
K1 |
K2 |
|
973K |
1.47 |
2.38 |
|
TK |
1.87 |
1.87 |
|
1173K |
2.15 |
1.67 |
I.从上表可以推断:△H2 0(填“>”或“<”)。
Ⅱ.现有反应③BD2(g)十A2(g) BD(g)+A2D(g) △H3,其平衡常数为K3,则K2的值为
(用K1、K2表示)。若在TK时,将2mol的BD2(g)和1
moIlA2(g)放入1L密闭容器中,A2的最大转化率为
。
BD(g)+A2D(g) △H3,其平衡常数为K3,则K2的值为
(用K1、K2表示)。若在TK时,将2mol的BD2(g)和1
moIlA2(g)放入1L密闭容器中,A2的最大转化率为
。
(4)有人设想寻求合适的催化剂和电极材料,以A2、C2为电极反应物,以HCl一NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式 。
15.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C)。其中正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
第Ⅱ卷(必做120分+选做32分,共152分)
第Ⅱ卷共13大题,其中23-30题为必做部分,31-35题为选做部分,考生必须从中选择2个物理题、1个化学题和1个生物题作答。不按规定选做者,阅卷时将根据所选科目题号的先后顺序只判前面的2个物理题、1个化学题和1个生物题,其他作答的题目答案无效。
[必做部分]
14.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论正确的是

A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2 >T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1:3
13.下列各组离子,在指定的环境中一定能够大量存在的是
A.有Fe3+大量存在的溶液中:Na+、Cl+、K+、SCN-
B.滴加酚酞显红色的溶液中:NH4+、Al3+、SO42、NO3-
C.加入铝单质能产生大量氢气的溶液中:Na+、NO3-、SO42-、C1-
D.有大量CO32-存在的无色透明溶液中:Na+、K+、C1-、[Al(OH)4] -
12.设NA为阿伏加德罗常数,下列说法正确的是
A.常温下,2g H218中含有的中子数为NA
B.标准状况下,2.24 L四氯化碳中含碳原子数为0.1 NA
C.1 molFeCl3和沸水完全反应转化为氢氧化铁胶体后,其中胶体粒子数目为NA
D.常温下,pH=1的1 L醋酸溶液中,醋酸根离子的数目为0.1NA
11.下列涉及有机化合物的说法正确的是
A.乙醇可以转化成乙酸,乙醇和乙酸都能发生取代反应
B.所有烷烃和蛋白质分子中都存在碳碳单键
C.人们通常用聚乙烯、聚氯乙烯塑料来制食品包装袋,它们都是高分子化合物
D.苯和乙烯都能使溴水退色,其退色原理是相同的
10.下列叙述正确的是
A.碱性氧化物都是金属氧化物,酸性氧化物都是非金属氧化物且不能与酸反应
B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且该产物溶于浓硝酸
C.在氯水中放入有色布条,一会儿有色布条褪色,说明氯水中有Cl2存在
D.用铂电极电解CuSO4溶液,当Cu2+浓度降低至原来一半时,停止通电,若加入一定质量的Cu(OH)2可使溶液恢复到原来的浓度和质量
9.化学与生产、生活、社会密切相关。下列有关说法中不正确的是
A.“碳纳米泡沫”被称为第五形态的单质碳,与石墨互为同素异形体
B.“神七”宇航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应
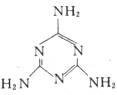
D.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如下图所示,其化学式为G3H6N6,相对分子质量为126
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com