
16.(10分)[物质结构与性质]
A、B、C、D四种元素原子序数依次增大,A是核外电子数目最少的元素,B元素基态原子的价电子排布式为ns2np2,C 元素基态原子中有两个未成对电子,D元素逐级失去前5个电子的电离能数据见下表:
|
|
I1 |
I2 |
I3 |
I4 |
I5 |
|
电离能kJ·mol-1 |
578 |
1817 |
2745 |
11575 |
14860 |
(1)当A原子核外电子在一定条件下从基态跃迁到激发态时产生的光谱属于 光谱(填“吸收”或“发射”)。
(2)美国科学家成功地在高压下将元素B、C形成的一种化合物转化为具有类似SiO2结构的晶体。在该晶体中,每个B原子周围结合 个C原子,1mol该晶体中含B-C键的数目为 NA,在该晶体中,B原子的杂化方式为 。
(3)D元素的最高化合价为 。
15.(15分)氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应N2(g)+3H2(g)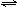 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
|
t/℃ |
200 |
300 |
400 |
|
K |
K1 |
K2 |
0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”=
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g) 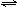 N2(g)+3H2(g)的化学平衡常数的值为
。
N2(g)+3H2(g)的化学平衡常数的值为
。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的υ(N2)(正) υ(N2)(逆)(填写“>”、“=”或“<”=。
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液显酸性,若0.1 mol/L的N2H6Cl2溶液在某温度时的pH为a,则溶液中N2H62+离子浓度为 mol/L(不考虑第二步水解。)
[选做部分]
共2题,考生只能从中选择1题在答题纸规定的区域作答,并写清题号。
14.(15分)海水是人类的资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
I、海水淡化历史最悠久、技术最成熟的方法是 。
II、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

(1)步骤①反应的离子方程式是 。
(2)步骤③反应的化学方程式是 。
(3)提取溴单质,采用蒸馏“溴水混合物II”而不是蒸馏“溴水混合物I”,请说明原因
。
III、(1)请写出电解食盐水制取氯气的化学方程式 。
(2)若电解2 L饱和食盐水,通过电路的电子的物质的量为2 mol ,则若用混合均匀后的pH为 ;若用该溶液将阳极产物全部吸收,反应是离子方程式为 ,所得溶液的pH 7(填“>”、“=”、“ <”=,理由是 。
(3)已知常温下三种物质电离反应的平衡常数如下:
H2CO3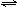 HCO3-+H+
K1=4.45×10-7,HCO3-
HCO3-+H+
K1=4.45×10-7,HCO3-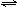 CO32-+H+ K2=5.16×10-11,,HClO
CO32-+H+ K2=5.16×10-11,,HClO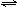 ClO-+ H+ K3=2.95×10-8,请写出氯气和碳酸钠物质的量之比为1∶1时,把氯气通入碳酸钠溶液中反应的离子方程式:
。
ClO-+ H+ K3=2.95×10-8,请写出氯气和碳酸钠物质的量之比为1∶1时,把氯气通入碳酸钠溶液中反应的离子方程式:
。
13.(10分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式: ,有人认为合金与烧碱溶液形成了原电池,写出其原电池负极的电极反应式: 。
(2)由滤液A制AlCl3溶液途径有①和②两种,你认为合理的是 。
(3)用粗制氧化铜通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是 、 。
12.(10分)某新型高效净水剂,其主要成分是PAFC(聚合氯化铝铁[AlFe(OH)nCl6-n]m)),广泛用于日常生活用水和工业污水的处理某化工厂欲以工业废料(金属铁、铝及其氧化物)为原料制取PAFC,涉及生成流程如下:
请回答:
(1)下列关于PAFC的说法正确的是( )
a.PAFC是一种无机高分子化合物
b.PAFC中Fe显+2价
c.PAFC溶于水能电离出OH-,是一种碱
d.PAFC在强酸性和强碱性溶液中均不能稳定存在
(2)写出向溶液中加入NaClO3时,发生反应的离子方程式 。
(3)该化工厂的化验室为测定该净水剂中Al和Fe的含量,进行下列试剂的选择和基本操作:
①测定时所需试剂有 。
a.NH3·H2O b. NaOH c. CO2 d.NaClO3
②测定时,直接测定质量的物质是 和 (填化学式)。
③在测定过程中的操作顺序是:过滤、 、灼烧、 、称量(写操作名称)。
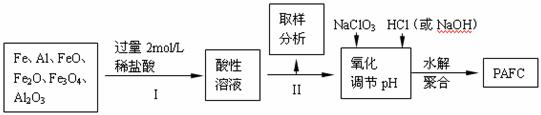
11.(10分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质不同的是 (填代号)。
a.84消毒液(NaClO溶液) b.75%酒精 c.臭氧 d.双氧水
(2)上述流程中可以循环使用的物质有 、 (写化学式)。
(3)若不考虑实际生产过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(4)该生产中需要纯净的CO2气体。
①若实验室要制备纯净的,所需试剂最好选择 (选填代号)。
a.石灰石 b.浓盐酸 c.稀硫酸 d.纯碱
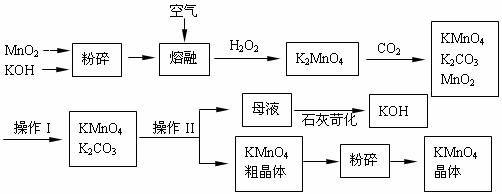
②所需气体发生装置是 (选填代号)。
10.将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。用数轴表示的下列化学知识中正确的是 ( )
A.分散系的分类 B.平衡常数与转化率关系

C.向AlCl3溶液滴加NaOH溶液后铝的存在形式 D.Na与O2反应的产物

第II卷(非选择题)
9.在标准状况下,V L氯化氢气体溶于1 L水中,所得溶于的密度为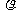 g·cm-3,溶液的质量分数为ω。则此溶液的物质的量浓度为 ( )
g·cm-3,溶液的质量分数为ω。则此溶液的物质的量浓度为 ( )
A. mol·L-1
B.
mol·L-1
B. mol·L-1
mol·L-1
C. mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
8.在一定体积的密闭容器中,反应aA(g)+bB(g)=xC(g)有如下图示关系,下列说法中正确的是 ( )

A.图2 y轴表示反应物A的转化率
B.a+b<x
C.图2 y轴表示平衡混合气体中B的质量分数
D.该反应的正反应为吸热反应
7.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解质溶液,下列有关说法不正确的是 ( )

A.该能量转换系统中的水可以循环利用
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-+4e-=2H2O+O2↑
D.燃料电池放电时的正极反应:O2+4e+2H2O=4OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com