
9.气体X可能含有NH3、Cl2、HBr、CO2中的一种或几种,将X通入硝酸银溶液,产生不溶于稀硝酸的淡黄色沉淀;若将X通入澄清的石灰水中,没有明显现象,则下列关于X成分的判断正确的是 ( )
A.可能含有HBr
B.一定不含有CO2
C.一定不含有NH3和Cl2,可能含有CO2
D.一定含HBr,可能含CO2和Cl2
8.在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO-3、S2- ②K+、Fe2+、I-、SO2-4
③Na+、Cl-、NO-3、SO2-4 ④Na+、Ca2+、Cl-、HCO-3
⑤K+、Ba2+、Cl-、NO-3
A.①③ B.③⑤ C.③④ D.②⑤
7.可逆反应:2NO2
 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2 nmolNO2
②单位时间内生成n molO2的同时生成2 nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.①④⑤⑥ C.①③④ D.①②③④⑤⑥
6.下列说法中,不正确的是 ( )
A.室温下,CH3COOH分子可以存在于pH=8的碱性溶液中
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+可能大量存在
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
25.(15分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
装置图
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
24.(8分)A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有转化关系:
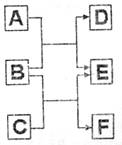
(1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气。B、D、F皆为非金属单质,且D为气体。则A的结构式为 ,1molC中含有 个共价键
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体。则
①A、C、E沸点由高到低的顺序为 (填化学式)。
②A跟D常温下反应可生成一种单质,化学方程式 。
23.(8分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E与其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应。根据以上信息,回答下列问题:
(1)A和D的氢化物中,稳定性较弱的是 (选填A或D);A和B的离子中,半径较小的是 (填离子符号)。
(2)元素C在元素周期表中的位置是 。
(3)E元素的名称是 。
22.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
21.(6分)铵盐受热分解的过程,就是铵离子(NH4+)把质子(H+)转移给酸根的过程,对于相同类型的铵盐,可根据上述反应判断其稳定性。试比较NH4F、NH4Cl、NH4Br、NH4I的稳定性,它们的热稳定性顺序是 ;理由是 。
20.将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是 ( )
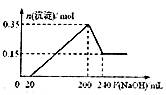
A.镁和铝的总质量为9.5g
B.盐酸的物质的量浓度为5mol·L-1
C.NaOH溶液的物质的量浓度为5mol·L-1
D.生成的氢气在标准状况下的体积为11.2L
第Ⅱ卷(选择题 共45分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com