
12.下列叙述中不正确的是 ( )
A.Na、NaCl、SiO2的熔点逐渐升高
B.1 mol乙醛与足量新制的银氨溶液反应生成1 mol Ag
C.一定条件下可将干冰转化或组成为“CO2"的原子晶体,该晶体中每个碳原子与四个氧原子结合
D.工业上通常用电解熔融MgCl2的方法冶炼Mg
11.一定温度下,容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:
2HI(g) H2(g)+I2(g);△H>0下列说法正确是 ( )
H2(g)+I2(g);△H>0下列说法正确是 ( )
A.若每消耗2n mol HI的同时生成n mol H2,表明该反应已达平衡
B.容器内的压强不发生变化,表明该反应已达平衡
C.平衡时,其它条件不变,再充入一定量HI,重新达平衡后;I2的百分含量增大
D.平衡时,其它条件不变,升高温度,混合气体的颜色加深
10.常温下,有甲、乙两份体积均为1 L,pH均为3的溶液,其中甲为醋酸,乙为盐酸。
① 甲用蒸馏水稀释至l00倍后,溶液的pH变为a;
② 乙与等体积、浓度为l.5 mol/L的氨水混合,在此混合液中:
N(NH4+)+ n(H+)-n(OH-)=bmol。
则a、b正确的答案组合是 ( )
A.3~5之间;0.0005 B.3~5之间;0.001
C.5;0.0005 D.5;0.001
9.具有强氧化性的高铁酸盐(FeO42-)是公认的绿色、高效的水处理剂,其制备方法可以表示为aFe3++bClO-+cM=dFeO42-+eCl-+fH2O,关于该反应下列说法中正确的是 ( )
A.M代表H+
B.FeO42-是氧化产物
C.ClO-在反应中被氧化
D.生成l mol FeO42-时共转移l.5 mol电子
8.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.32g氧气和臭氧的混和气体中含有的氧原子数为2NA
B.标准状况下,22.4 L CH3CH2Br中所含分子数为NA
C.0.1 mol H3O+所含质子数为NA
D.0.1 mol Fe和足量的稀硝酸充分反应,转移电子数为0.2NA
7.下列各组离子中,加入盐酸或NaOH溶液都能大量共存的是 ( )
A.Al3+、K+、HCO3-、Cl- B.Ba2+、Na+、Cl-、SO42-
C.Na+、Cl-、Br-、I- D.Na+、K+、Ag+、NO3-
6.2008年8月,某品牌婴幼儿奶粉污染事件震惊全国。不法分子利用了目前食品工业中蛋白质含量的测定方法--凯氏定氮法(其核心内容是“先检测食品中氮元素的含量,然后再乘适当的换算因子后得出蛋白质含量”)的缺陷,向奶粉中添加一种很稳定的物质三聚氰胺(分子式C3H6N6)而提高蛋白质的检测值。下列有关蛋白质及凯氏定氮法的叙述正确的是
( )
A.三聚氰胺可以将其它物质转化为蛋白质
B.用鸡蛋壳膜和蒸馏水及必要仪器不能除去蛋白质胶体中的食盐
C.一切重要的生命现象和生理机能,都与蛋白质有着密切关系
D.向食品中添加尿素[CO(NH2)2]比添加三聚氰胺更能提高蛋白质的检测值
(二)选考题:(共15分,请考生从给出的3道试题中任选一题做答。如果多做,则按所做的第一题计分。)
29.[化学--选修化学与技术](15分)
我国有较长的海岸线,浩瀚的海洋是一个巨大物质资源和能量的宝库。目前世界各国都在研究如何充分利用海洋资源。
(1)如下图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
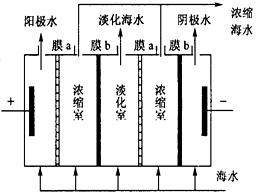
①图中膜a应选用 膜。
②电渗析法还可以用来处理电镀废液,
写出该方法处理含硫酸铜废液时(使用惰性电极)所发生的电极反应式为:阴极 ;阳极 。
(2)海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
(i)空气吹出纯碱吸收法。该法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸化,即可得到单质溴。该方法涉及的反应有:
① (写出化学反应的离子方程式);
②3Br2+2CO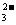 =BrO
=BrO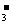 +5Br-+3CO2↑;
+5Br-+3CO2↑;
③BrO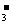 +5Br-+6H+=3Br2+3H2O。
+5Br-+6H+=3Br2+3H2O。
其中反应中③氧化剂是 ,还原剂是 。
(ii)溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度不同的原理来进行的。实验室中萃取用到的主要玻璃仪器名称是 。下列可以用于从海水中萃取溴的试剂是(填写编号) 。①乙醇,②四氯化碳,③硝酸
(3)海水中的氘(含HDO0.3%)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25°C和100°C两种不同的温度下发生的两个不同反应得到较高浓度的HDO。
下图为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线。写出100°C时所发生反应的化学方程式 ;
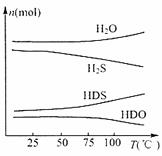
工业上富集HDO的生产过程中,可以循环利用的一种物质是 。
|
图表法、图象法是常用的化学科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径 (10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
|
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素在元素周期表中的位置: 周期; 族,其基态原子的核外电子排布是 。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出两种即可,)元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其E分子共形成 个σ键。 个π键
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第 族。
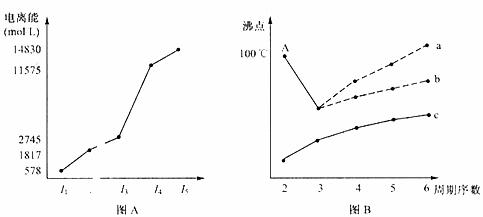
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋热画出了两条折线--折线a和折线b,你认为正确的是 ,理由是 。
31.[化学--选修有机化学基础](15分)
目前,化学农药已进入一个超高效、低毒化、无污染的新时期。一种高效、低毒农药“杀灭菊酯”的合成路线如下:

已知:
F可能发生银镜反应。请回答问题:
(1)写出A、C结构简式:A ;C 。
(2)下列变化的反应类型是:B→C ;E→F
(3)写出下列变化的化学方程式:
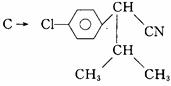
E→F ;
D+C 。
(4)解决有机分子结构问题的最好的手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。在核磁共振氢谱中A物质会出现 组峰,其吸收峰的面积之比为 。
(5)写出分子中有两个苯环,还能与NaHCO3反应放出气体且与F互为的同分异构体所有有机物的结构简式: 。
(一)必考题(共5题,共44分)
24.(7分)水是生命之源,也是化学反应中的明星物质。试回答下列问题:
(1)写出水的电子式 。
(2)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
25.(6分)A、B、C、D常见的不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,D元素原子最外层电子数是C元素原子最外层电子数的二倍,B元素原子的最外层最子数比D的最外层电子数少两个。E也是短周期元素,与D同主族。
(1)写出B元素符号 ,画出E的原子结构示意图 。
(2)由上述五种元素中的三种组成的易溶于水的物质中,能促进水电离物质M的化学式是 ,其与水反应的离子方程式为 能抑制水电离的物质N的名称是 (写出一种物质即可。)
26.(8分)某溶液中可能含有CO 、SO
、SO 、HCO
、HCO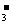 三种离子中的一种、两种或三种都有。为探究其组成,现取出两份相同的样品溶液中试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氢氧化钡溶液,产生白色沉淀。请设计合理实验,在此实验的基础上做进上步实验,得出实验结论。
三种离子中的一种、两种或三种都有。为探究其组成,现取出两份相同的样品溶液中试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氢氧化钡溶液,产生白色沉淀。请设计合理实验,在此实验的基础上做进上步实验,得出实验结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、1mol/L硫酸、2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡、1mol/L氢氧化钡、澄清石灰水、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设1:溶液只存在CO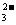
假设2: 。
假设3: 。
假设4: 。
假设5: 。
假设6:溶液中存在CO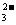 、SO
、SO 、HCO
、HCO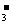 。
。
(2)基于假设6,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。(可不填满,也可增加步骤)
|
步骤编号 |
实验步骤及预期现象和结论 |
|
① |
|
|
② |
|
|
③ |
|
|
④ |
|
27.(13分)、氨是重要的化工原料,合成氨是是哈伯1905年发明的。2001年希腊化学家提提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气分别通入一个加热到57℃的电解池中,H2和N2在电极上合成氨。此法的转化率大为提高。已知:
N2(g)+3H2(g) 2NH3(g) △H<0。 请回答下列问题:
2NH3(g) △H<0。 请回答下列问题:
(1)电解法合成氨可以使用水做电解液吗? ,为什么 。
(2)若合成氨反应容器的容积为2L,开始充入3mol/LH2和1mol/LN2反应达到平衡时气体的压强变为原来的7/8,则氮气的转化率为 。
该反应的化学平衡常数的表达式为 ,升高温度,平衡常数将 。(填增大、减少或不变);增大反应容器的体积,再达到平衡时,混合气体的平均分子量将 。(填增大、减少或不变)。
(3)在这一条件下氨可与其它物质反应生成尿素[CO(NH2)2],已知30g尿素在高温高压下分解生成11.2LNH3(标况)、5.6LCO2(标况)和一定质量的三聚氰胺分子(三聚氰胺的相对分子质量为126)。不法分子曾在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中蛋白质含量,导致许多婴儿肾结石。写出三聚氰胺的分子式 。其化学反应方程式为 。三聚氰胺分子中有一个六元杯,一个三聚氰胺分子可分解生成三个分子A,则A的结构式是 。
28.(10分)A、B、C、D、E是中学化学常见的单质,其中只有A、C在常温下为气态。E的摩尔质量是A的2倍,F、G、H、I、J5种化合物分别由上述五种元素中的两种组成。D与F反应放出大量的热。它们之间的转化关系如下图所示(反应条件已省略):

请回答下列问题:
(1)元素B在周期表的位置是:周期 ,族 。
(2)写出D与F反应的化学方程式 。该反应在工业生产中的用途是
(至少写出一点)。
已知H能与烧碱溶液反应,写出该反应的离子方程式 。
(3)若J中含有B元素,写出检验化合物J中阳离子的有关离子方程式: 。
23.已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s)△H=-351.1kJ/mol
Hg(l)+1/2 O2(g)=HgO(s)△H=-90.7kJ/mol
由此可知热化学方程Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H为 ( )
A.-260.4kJ/mol
B.-254.6kJ/mol
C.-483.9kJ/mol
D.-441.8kJ/mol
第Ⅱ卷(非选择题,共59分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com