
29.(16分)有机物A由C、H、O形成元素组成,相对分子质量为150。已知A中苯环上有两个取代基,且A不能使FeCl3溶液显色,也不能发生消去反应。现有下列转化关系,其中C是B发生分子内酯化的产物,且C分子中有两个六元环。
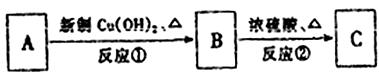
请回答:
(1)A中的含氧官能团名称为 、 。
(2)反应①的反应类型 ;反应②的反应类型 ;
(3)反应①的化学方程式为 。
(4)反应②的化学方程式为 。
(5)B在一定条件下能生成一种高分子化合物,请写出该反应的化学方程式
(6)写出符合以下条件的属于酯类的A的同分异构体:I苯环上有两个取代基,其中一个为甲基;Ⅱ苯环上的一氯代物有两种 。
28.(14分)已知A、B、D、E四种物质中含有同一种短周期元素,D为气体单质,E为黑色粉未,在下图转化中E均起催化作用(某些产物已略去)。
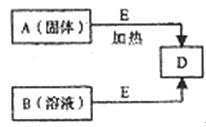
请回答:
(1)A的化学式为 ;B分子的结构式为 。
(2)已知E与A中某种元素形成的酸在一定条件下反应,产生一种含有该元素的气体X。某校化学兴趣小组为研究该气体的性质,设计下图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
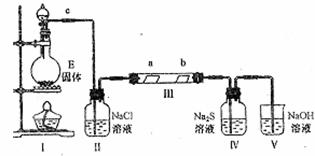
①写出装置Ⅰ中发生反应的离子方程式
;
②实验过程中,观察到装置Ⅳ中出现淡黄色沉淀,其主要反应的离子方程式为
③实验结束后,该同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为在装置(选填装置序号)
之间,还应添加洗气瓶,该装置的作用是 ;
27.(16分)Fe是一种重要的金属,具有很多的重要用途。
(1)铁元素在周期表中的位置是 周期 族
(2)电子工业用FeCl3腐蚀铜的原理制造印刷电路板,写出FeCl3与Cu反应的离子方程式: ;
(3)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈血红色,则溶液中含有的金属阳离子是:
;
在此基础上,又进行了定量组成的测定:
再取50.0mL待测溶液,向其中加入过量稀硝酸,得到0.448L(标准状况下)一种无色气体。写出反应的离子方程式: 。
待测溶液中c(Cu2+)= mol·L-1。(不考虑水解)
(4)在光照条件下,乙醇被FeCl3氧化生成一种能发生银镜反应的物质,写出反应的化学方程式: 。
26.(14分)短周期元素A、B、C、D原子序数依次增大,且只有C元素金属元素,A、C位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D的最高价氧化物对应的水化合物名称为 。
(2)C2B2的电子式为 ,其中含有的化学键类型为 。
(3)由上述四种元素中的三种按原子个数比为1:1:1组成某种盐,是家用消毒剂的主要成分,水溶液呈 性(填酸、碱或中),用离子方程式解释其原因 。
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为 ,
若阳极得到的气体在标准状况下的体积为2.24L,则外路中通过电子的物质的量为
。
13.没食子儿茶素的结构简式如下,它是目前尚不能人工合成的纯天然、高效能的抗氧化剂。下列有关该物质的叙述正确的是 ( )
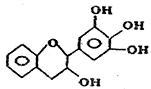
A.分子式为C15H12O5
B.1mol该物质与4molNaOH恰好完全反应
C.该物质在浓硫酸作用下可发生消去反应
D.该物质可以和溴水发生取代反应和加成反应
第Ⅱ卷(非选择题,共174分)
第Ⅱ卷共10题,用黑色碳素笔将答案答在答题卷上。答在试卷上的答案无效。
12.下列说法正确的是 ( )
A.若HA、HB均为弱酸,酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB
B.相同条件下,将pH=11的NaOH溶液和和氨水分别稀释pH=9的溶液,所加水的体积前者大
C.pH=3的醋酸与pH=1的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是
C(Na+)>c(CHCOO-)>c(OH-)>c(H+)
D.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
11.关于下列各装置图的叙述中,不正确的是 ( )
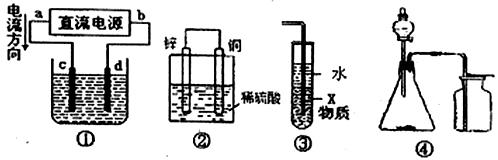
A.若采用装置①精炼铜,则c极为粗铜,d极为纯铜,电解质溶液为CuSO4溶液。
|
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于电石和水制取并收集乙炔
10.合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),△<0,在573K、300Mpa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g),△<0,在573K、300Mpa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
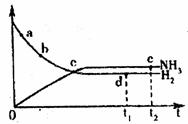
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小
9.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的 ( )
A.分子数和气体质量均不同 B.分子数和电子数均相同
C.质子数和中子数均相同 D.分子数、原子数和中子数均相同
8.下列离子方程式中正确的是 ( )
A.向苯酚钠溶液中通入少量CO2: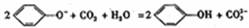
B.氨水中加入明矾溶液:3NH3·H2O+Al3+=Al(OH)3↓+3NH4+
C.石墨做电极,电解硫酸铜溶液:Cu2++2H2O Cu+O2↑+4H+
Cu+O2↑+4H+
D.氯气溶于水:Cl2+H2O=Cl-+ClO-+2H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com