
27.(15分)有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要有机溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:________________(用化学式表示)。
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元素组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见下图所示转化关系:
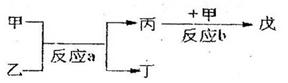
①试推测戊可能为:__________________、___________________(列举合适的两例)。
②若甲是O2、乙是NH3,1gNH3发生反应a生成单质和液态化合物时放出QKJ的热量,则反应的热化学方程式为:_______________________________________。
(3)若下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物。已知:A是常见的金属单质,反应C为置换反应类型。
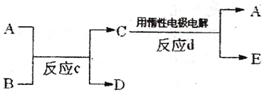
①若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如上图示转化关系。则反应d中阴极的电极反应式为:_______________________________________。
②若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式为:______________________________。
26.(12分) A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,B是最活泼的非金属元素,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是最强的含氧酸之一。
(1)B在周期表中的位置:第 周期第 族;E的元素符号为_______ ;
化合物甲的电子式为_____________。
(2)物质乙可用于潜艇或航天飞机作供氧剂,写出乙与CO2反应的化学方程式:
____________________________ 。
(3)单质D与C的最高价氧化物对应水化物溶液反应的离子方程式:
______________________________________________________________________ 。
(4)1 mol 单质B的气体与1 mol C的氢氧化物在一定条件下恰好完全反应,生成一种盐、水及另一种气体,则所得气体的化学式为:__________________________ 。
13.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如图所示:下列关于固体燃料电池的有关说法正确的是
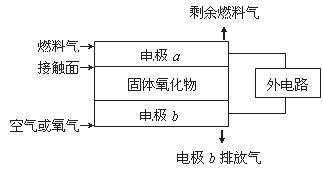
A.电极b为电池负极,其电极应式O2+4e-=4O2-
B.固体氧化物的作用是让电子在电解池内通过
C.若C2H4作为燃料气,则接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
D.若H2作为燃料气,则接触面上发生的反应为:H2+2OH--4e-=2H++H2O
第Ⅱ卷 非选择题(共174分)
12.下列叙述正确的是
A.常温下,10 mL pH=12的Ba(OH)2溶液与40 mLcmol·L-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50 mL,则溶液pH=11。
B.某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA- 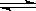 H++A2-;则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)
H++A2-;则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)
C.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合:
c(Na+)+c(H+) = 2c(CO32-)+c(OH-)
11.下列各项操作中不发生先沉淀后溶解现象的是
①向饱和Na2CO3溶液中通入过量CO2
②向Fe(OH)3胶体中逐滴滴入过量的H2SO4
③向AgI胶体中逐滴加入过量稀盐酸
④向石灰水中通入过量CO2
⑤向Na2SiO3溶液中滴入过量的盐酸
A.①②③ B.②③⑤ C.①②③⑤ D.①③⑤
10.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属不溶解
B.若金属全部溶解,则溶液中不一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
9.如图,在一定温度下,Ⅰ为恒压体积可变的密闭容器,Ⅱ为恒容密闭容器。在Ⅰ、Ⅱ中分别加入2 mol A和2 mol B,起始时容器体积相等且均为V L,发生如下反应并达到化学平衡状态:2A十B xC(g),平衡时两容器中A、B、C的物质的量之比均为
xC(g),平衡时两容器中A、B、C的物质的量之比均为 1:3:6。下列说法一定正确的是
1:3:6。下列说法一定正确的是
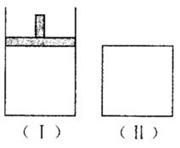
A.x的值为3
B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于V L
8.下列各组离子能在指定溶液中共存的是
①无色溶液中:K+、Cl-、Na+、H2PO4-、PO43-、SO42-
②使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32-
③水电离的C(H+)=10-13mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+、S2O32- ④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A.①③ B.②④⑤ C.①②⑤ D.③⑥
7.下列反应的离子方程式书写正确的是
A.烧碱溶液和过量Ca(HCO3)2溶液反应:
2OH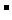 +Ca
+Ca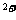 +2HCO3
+2HCO3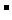 =CaCO3↓+CO3
=CaCO3↓+CO3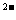 +2H2O
+2H2O
B.碳酸钙与醋酸溶液反应:CaCO3+2H =Ca
=Ca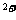 +CO2↑+H2O
+CO2↑+H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe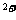 +2H
+2H +H2O2=Fe
+H2O2=Fe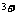 +2H2O
+2H2O
D.向硫酸铜溶液中滴加氢氧化钡溶液至SO4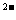 恰好沉淀完全:
恰好沉淀完全:
Cu2++SO4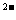 +2OH-+Ba
+2OH-+Ba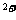 =BaSO4↓+Cu(OH)2↓
=BaSO4↓+Cu(OH)2↓
6.2008年北京奥运会奥运场馆“鸟巢”使用的代号Q460的特殊钢是合金,Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、 Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列说法正确的是
A.Fe属于过渡元素,位于元素周期表的第四周期、第ⅧB族
B.工业上利用铝热反应可以冶炼金属Fe、Cr、Mn
C.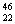 TiO2、
TiO2、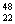 TiO2、
TiO2、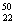 TiO2 互为同位素,性质完全相同
TiO2 互为同位素,性质完全相同
D.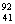 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com