
8.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴 入酚酞溶液,在F极附近显红色。则以下说法正确的是 ( )
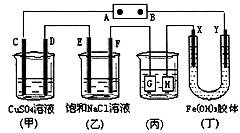
A.电极B极是正极
B.(甲)、(乙)装置的C、D、E、F 电极均有单质生成,其物质的量之比1:2:2:2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中看到的现象是X极附近红褐色变深
7.室温时,某溶液中水电离出的c(H+)=10-13mol/L,下列离子在溶液中一定能大量共存的是 ( )
A.Fe3+、NH4+、Cl-、I- B.Ba2+、Na+、Cl-、NO3-
C.K+、HCO3-、Br-、Ba2+ D.K+、CO32-、NO3-、Al3+
6.下列各项中的两个量,其比值一定为2:1的是 ( )
A.100mL1.0mol·L-1Fe(NO3) 2溶液与200m0.5mol·L-1HNO3溶液混合,混合前和混合后c(NO3-)之比
B.相同温度下,0.2 mol·L-1醋酸溶液与0.1 mol·L-1醋酸溶液中c(H+)之比
C.NH4+浓度相同时,CH3COONH4溶液与(NH4) 2SO4溶液的物质的量浓度之比
D.室温时pH=2的HCl溶液与pH=12的Ba(OH) 2溶液的物质的量浓度之比
5.下列离子方程式中正确的是 ( )
A.NaHCO3溶液与足量的Ca(OH)2溶液:
Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32-
B.铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D.氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
4.下列对有关实验事实的解释正确的是 ( )
A.酸性KMnO4溶液中通入SO2后,颜色褪去,是因为SO2具有漂白性
B.铁在海水中比在淡水中更易腐蚀,是因为海水中含丰富的氧气
C.常温下,将铝片放入浓硫酸中无明显现象,是因为铝不和冷的浓硫酸反应
D.浓硝酸在光照条件下变黄,是因为浓硝酸分解生成的有色产物溶于浓硝酸
3.设NA表示阿伏伽德罗常数,下列说法正确的是 ( )
A.常温常压下33.6LCl2与足量Fe反应,转移的电子数为3NA
B.1molNO2与足量H2O反应,转移的电子数为NA
C.由CO2和O2组成的混合物共有NA个分子,其中的氧原子数为2NA
D.1molCO2分子中共价键总数为2NA
2.下列装置能达到实验目的的是 ( )

A.吸收氨气制氨气 B.制取少量蒸馏水C.转移溶液 D.除去杂质气体CO2
1.下列有关物质分类或归类正确的是 ( )
① 酸性氧化物:SO2、NO2、CO2、SiO2
② 非电解质:液氨、氨水、液态氯化氢、过氧化氢
③ 电解质:氯化铝、胆矾、冰醋酸、硫酸钡
④ 同位素:H、D、T、HD
⑤ 同素异形体:C60、C70、金刚石、石墨
⑥ 离子化合物:CH3COONa、Al2O3、Na2O2、CaC2
A.①③⑤ B.②④⑤ C.①②④ D.③⑤⑥
28.(18分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:

实验时有如下操作:A.将玻璃管中样品加热到800℃~850℃。 B.称取研细的黄铁矿样品。 C.连接好全部仪器,并检查其气密性。 D.将样品小心放入硬质玻璃管中部。E.以均恒的速度不断鼓入空气。F.用标准碘溶液滴定含淀粉的SO2水溶液。
(1) 正确的实验步骤的次序是(以A、B┅的序号表示) 。
(2) 装置①的作用是 ;装置②的作用是 。
(3) 碘跟SO2水溶液反应的离子方程式为 。
(4) 根据 现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点 (填是或否),请说出你的主要理由 。
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.0900g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500 mol·L-1,则该黄铁矿样品中硫元素的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com