
9.某同学设计了如图的方法对A盐进行鉴定
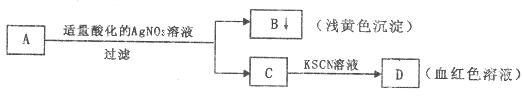
由此分析,下列结论中,正确的是
A.C中一定有FeCl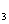 B.A中一定有Fe
B.A中一定有Fe
C.B为AgI沉淀
D.A中一定有Br
8.在给定条件下,下列各组离子一定能大量共存的是
A.能和铝反应放出氢气的溶液中:Na 、NH
、NH 、C1
、C1 、SO
、SO
B.能使酚酞试液变红的无色溶液中:Na 、HCO
、HCO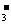 、NO
、NO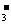 、ClO
、ClO
C.由水电离产生的c(H )= 1.0×10
)= 1.0×10 mol/L的溶液中:K
mol/L的溶液中:K 、HCO
、HCO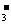 、Al
、Al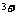 、NO
、NO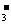
D.能使碘化钾淀粉试纸变蓝的溶液中:K 、Fe
、Fe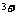 、SO
、SO 、Cl
、Cl
7.短周期元素X、Y的原子序数相差2,下列叙述正确的是
A.X与Y形成的化合物一定是离子化合物
B.x与Y不可能形成原子个数比为1:1型离子化合物
C.x离子与Y离子电子层结构可以相同,也可以不同
D.x与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
6.按下列实验装置进行相应实验,能达到实验目的的是

(二)选考题:共45分,请考生从给出的3道物理题.3道化学题.2道生物题中每科任选一题做答。如果多做,则每学科按所做的第一题计分。
33.[化学--化学与技术](15分)
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%;O2 11% ;N2 82%);
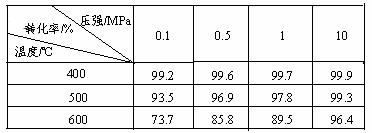
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量为 g,由SO2生产这些SO3所放出的热量为 kJ。
34.[化学--物质结构与性质](15分)
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的
键比
键稳定(填“ ”“
”“ ”)。
”)。
(3)(CH3)3NH+和AlCl-4可形成离子液体。离子液体由阴.阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
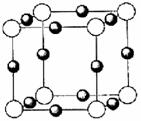
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如下图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
35.[化学--有机化学基础](15分)
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式为:

已知:Ⅰ.
Ⅱ.RCOOR1+R2OH→RCOOR2+R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
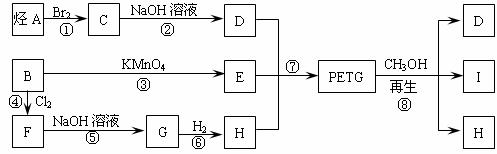
试回答下列问题:
(1)合成PETG的单体有 种。
(2)指出反应类型:② ⑥ 。
(3)写出A、B、I的结构简式:A ,B ,I 。
(4)G属于酚类的同分异构体有多种,其中酚羟基互为间位的同分异构体共有_____种。
(5)反应⑦中参加反应的D、E、H的物质的量之比为 。
(一)必考题(8题,共129分)
25.(14分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 。
(4)元素R与Y同主族,其氢化物能用于腐蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 。
26.(15分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)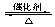 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
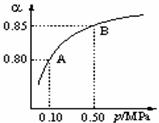
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_______(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如下图所示:
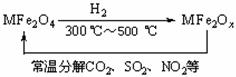
请写出MFe2Ox分解SO2的化学方程式 (不必配平)
27.(14分)下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
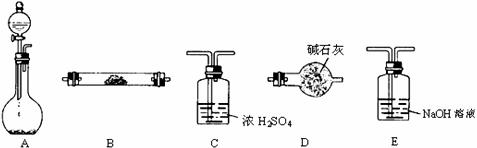
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2,验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是 、 (写化学式);D装置的作用是 。
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有 、 。(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
① 烧瓶内除了能产生O2外,还能产生大量NH3。能产生大量NH3的原因是:
a ; b ; c 。
② 用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是: → → → (填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是 (用字母表示);用化学方程式解释红棕色气体产生的原因: 、 。
13.已知绿茶中含有EGCG,该物质具有抗癌作用,EGCG的结构简式如下图所示,下列说法错误的是
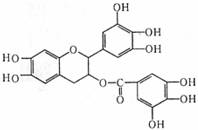
A.1molEGCG最多可与含10mol NaOH的碱溶液反应
B.1molEGCG最多可与含6molBr2的浓溴水反应
C.EGCG在空气中易被氧化
D.1molEGCG最多可与9mol H2发生加成反应
第Ⅱ卷
12.向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如下图所示。则下列说法正确的是

A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.在反应过程中,各状态点溶液的pH大小顺序是:e > d > c > a > b
C.b-c段与c-d段溶液中阴离子的物质的量相等
D.在d点,向溶液中加入盐酸,沉淀量将减少
11.下列叙述正确的是:
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
10.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3:1,其原因可能是:
A.两溶液的体积相同,酸是多元强酸
B.酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com