
1.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于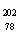 Pt的说法正确的是 ( )
Pt的说法正确的是 ( )
A.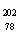 Pt和
Pt和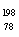 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B.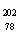 Pt和
Pt和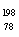 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C.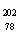 Pt和
Pt和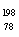 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. 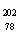 Pt和
Pt和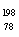 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
24.(8分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;Z元素在周期表中的位置是 、 。
(2)U、V、W形成的10电子氢化物中,氢化物沸点最高的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明______________________________。
(3)UW2中含有化学键为 。
23.(10分)A、B、C、D、E 5种元素,A元素所处的周期数、主族序数、原子序数均相等;B是地壳中含量最多的元素;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。E的单质既能与强酸反应,又能与强碱反应放出氢气
(1)B在周期表中的位置第 周期,第 族;
(2)C的最高价氧化物的化学式: ;
(3)D的最高价氧化物的水化物与E单质反应的化学方程式: 。
(4)这五种元素形成的盐的化学式: ,含有化学键 。
22.(10分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A B C D
(2)写出AB2与过量氢氧化钠反应的离子方程式
(3)用电子式表示化合物 C2D的形成过程 。
(4)C的单质在高温下与B的单质充分反应所得化合物中含有化学键为 。
21.(12分)按要求用合适的化学用语填空
Ⅰ.(8分)在原子序数1-18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_____________。
(6)电子数为10的分子(写5个)
Ⅱ.(4分)下列各分子中,所有原子都满足最外层为8电子结构的是
①H2O ②BF3 ③CF2Cl2 ④PCl3 ⑤SO3 ⑥N2 ⑦COCl2
20.下列各组物质中,两种物质所含化学键类型不同的是 ( )
A.H2O和HNO3 B.CaF2和Na2O2
C.NaCl和MgO D.Cl2和P4
19.镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是
( )
A.在化合物中呈+2价 B.单质使水分解、放出氢气
C.氢氧化物呈两性 D.镭的还原性大于镁
18.下列化合物电子式书写正确的是 ( )
A.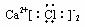 B.
B.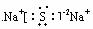 C.
C. D.
D. 
17.Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是 ( )
A.KCl B.NaF C.Na2O D.K2S
16.科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA 族,称为类铅。关于它的性质,预测错误的是 ( )
A.它的最外层电子数为4
B.它的金属性比铅强
C.它具有+2、+4价
D.它的最高价氧化物的水化物是强酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com