
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)用 (填实验用品名称)取固体混合物于烧杯中。
(2)上述实验可以得到的初步结论是 。
21.(10分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉KI试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
20.(13分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀中含CuCl21.5mol·L-1,含FeCl2 3.0mol·L-1,含FeCl31.0mol·L-1,含HCl3.0mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
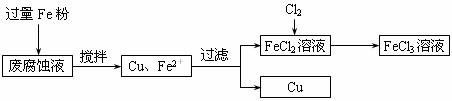
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是 (填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为 。
(3)下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。

从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。

(4)实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
(5)按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
19.(10分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OH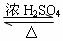 CH3COOC2O5+H2O
CH3COOC2O5+H2O
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到催化剂和吸水剂的作用,某同学利用下图所示装置进行了以下4个实验。
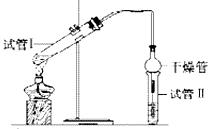
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管II再测有机层的厚度,实验记录如下:
|
实验编号 |
试管I中试剂 |
试管II中试剂 |
测得有机层的厚度/cm |
|
A |
3mL乙醇、2mL乙酸、1mL18mol·L-1浓H2SO4 |
饱和Na2CO3溶液 |
5.0 |
|
B |
3mL乙醇、2mL乙酸 |
0.1 |
|
|
C |
3mL乙醇、2mol乙酸6mL 3mol·L-1 H2SO4 |
1.2 |
|
|
D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸收性提高了乙酸乙酯的产率。浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是
。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
18.在t℃时,将agNH3完全溶解于水,得到V mL溶液,假设该溶液的密度为 g·cm-3,质量分数为w,其中含NH+4的物质的量为bmol。下列叙述中正确的是 ( )
g·cm-3,质量分数为w,其中含NH+4的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数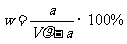
B.溶质的物质的量浓度
C.溶液中
|
第Ⅱ卷(非选择题,共87分)
17.下述实验能达到预期实验目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将10gCuSO4·5H2O溶解在90g水中 |
配制质量分数为10%的CuSO4溶液 |
|
B |
向盛有1mL硝酸银溶液的试管中滴加KI溶液,至不再有沉淀生成,再向其中滴加NaCl溶液 |
说明一种沉淀能转化为溶解度更小的沉淀 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
D |
室温下,用pH计测定浓度均为0.1mol·L-1的NaClO溶液和CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
16.常温下,下列各组数据中比值为2:1的是 ( )
A.电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比
B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比
C.1mol·L-1氨水溶液与0.5mol·L-1氨水溶液中c(OH-)之比
D.物质的量相同的水和乙醇与足量金属钠反应产生氢气的体积之比
15.某醋酸溶液与0.01mol·L-1NaOH溶液等体积混合(忽略溶液体积变化),混合后溶液显中性。则下列有关叙述不可能出现的是 ( )
A.混合液中c(Na+)=c(CH3COO-)
B.该醋酸溶液中c(H+)等于0.01mol·L-1
C.该醋酸溶液的物质的量浓度大于0.01mol·L-1
D.混合液中c(CH3COOH)+c(CH3COO-)=0.005mol·L-1
14.铅蓄电池用途极广,电解液为30%H2SO4溶液,电池的总反应式可表示为:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列有关叙述正确的是 ( )
2PbSO4(s)+2H2O(l),下列有关叙述正确的是 ( )
A.放电时电解液的密度不断增大
B.放电时电子从Pb通过导线转移到PbO2
C.充电时Pb极与外电源负极相连
D.充电时PbO2电极发生还原反应,Pb电极上发生氧化反应
13.短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层子数的3倍。下列说法一定正确的是 ( )
A.X和Y都是非金属元素,其中X的最高化合价为+5价
B.X与Y所能形成的化合物都是酸性氧化物
C.元素X可形成化学式为KXO3的盐
D.X的氢化物极易溶于水,可以用来做喷泉实验
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com