
11.能正确表示以下反应的离子方程式的是 ( )
A.向KHSO4溶液中加入Ba(OH)2溶液至中性:H++SO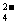 +Ba2+OH-=BaSO4↓+H2O
+Ba2+OH-=BaSO4↓+H2O
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
C.过量CO2通入Ca(OH)2溶液中:CO2+Ca2++2OH-=CaCO3↓+H2O
D.铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+
10.某密闭容器中发生如下反应:A(g)+B(g) 2C(g);△H<0,反应的速率(v)随时间(t)变化的关系如图,t2,t4,t5时刻外界条件改变,得都没有改变各物质加入量。下列说法正确的是 ( )
2C(g);△H<0,反应的速率(v)随时间(t)变化的关系如图,t2,t4,t5时刻外界条件改变,得都没有改变各物质加入量。下列说法正确的是 ( )
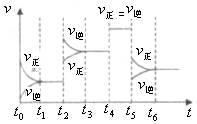
A.t2时增大了压强 B.t4时一定使用了催化剂
C.t5时降低了温度 D.t3~t4时间内A的百分含量比t6后低
9.现有酒精灯、圆底烧瓶、分液漏斗、胶塞、导管、铁架台、石棉网、沸石,不能用来实验室制备的气体是(注意:所给仪器和物品可不全用,药品任选) ( )
A.CO2 B.NH3 C.C2H4 D.Cl2
8.如图装置电解一段时间,当某极析出0.32gCu时,I、II、III中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计) ( )
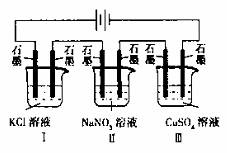
A.13、7、1 B.12、7、2 C.1、7、13 D.7、13、1
7.下列说法正确的是 ( )
A.硫酸工业制法中用水来吸收SO3
B.石油分馏后得到的是各种纯净的烃
C.工业上利用氯气和澄清石灰水反应来制取漂白粉
D.氯碱工业中阳离子交换膜能阻止气体和阴离子通过
6.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.100ml 1mol/L FeCl3溶液中含Fe3+离子的数目为0.1NA
B.标准状况下,2.24L.乙醛完全燃烧得到的CO2分子数为0.2NA
C.11g2H218O所含的分子数为6NA
D.80ml 10mol/L浓盐酸与足量MnO2在加热条件下充分反应,转移电子数为0.4NA
31.(15分)[化学选考题](以下三题[A、B、C]任选一题,若都答按前面一题计分)
A.[化学与技术模块]
某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备硫酸铵的工艺流程:

请回答下列问题:
(1)合成氨反应的化学方程式是_____________________________________。(2分)
(2)沉淀池中发生的主要反应方程式是________________________________。(2分)
在上述流程的沉淀池中通入足量氨气的目的是___________________________________
_________________________,(2分)可以循环使用的X是__________。(2分)
(3)该生产过程中副产品是____________。(2分)从绿色化学和资源综合利用的角度说明上述流程的主要优点是_____________________________________________;(2分)
从物质的性质和工业生产实际的角度考虑该流程的主要缺陷是_________________。(3分)
B.[物质结构与性质模块)
设X、Y、Z代表3种短周期元素,已知:
①Ym-和Zn-两种离子具有相同的电子层结构;
②Y与X可以形成原子个数比为1:1的化合物甲和1:2的化合物乙(常温下甲、乙为液态),甲和乙都是共价化合物;
③Z与X形成原子个数比为1:1的化合物丙,其分子与乙的分子所含质子数相同。
填写下面空白:
(1)Y元素的原子结构示意图:____(2分),Z元素的原子核外电子排布式____。(2分)
(2)化合物甲是由 键(2分)组成的 分子(填“极性”或“非极性”)。(2分)化合物乙的空间结构是:______________。(2分)
(3)Z单质与化合物乙发生反应的基本类型是________。(2分)(填四种基本化学反应类型)
(4)化合物丙与氢氧化钠溶液反应的离子方程式是_________________________。(3分)
C.[有机化学基础模块]
某有机物X是农药生产中的一种中间体,其结构简式为(如图)
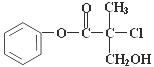
(1)X的分子式为____________(3分)
(2)X分子中含有的官能团有__________________________(用结构简式表示)(3分)
(3)X可能发生多种反应,下列有关X发生化学反应的叙述中正确的是( ) (多选扣分)(3分)
A.在氢氧化钠醇溶液中共热能发生消去反应
B.在铜作催化剂时加热,可被氧气氧化生成能发生银镜反应的物质
C.在浓硫酸存在时加热可发生消去反应
D.在铁作催化剂时,可跟液溴发生取代反应
(4)写出X跟氢氧化钠稀溶液共热时所发生反应的化学方程式
________________________________________________。(3分)
(5)X可能有多种同分异构体,写出符合下列条件的一种同分异构体的结构简式__________。(3分)
①苯环只有分处在对位的两个取代基
②遇氯化铁溶液不变色,但遇pH试纸显红色
27.(14分)在一个固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g)+2B(g)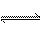 3C(g)已知加入1
mol A和3molB,5分钟后达到平衡,生成了a
molC
3C(g)已知加入1
mol A和3molB,5分钟后达到平衡,生成了a
molC
(1)从开始到平衡用A表示该反应的平均反应速率________mol/(L·min) (3分)(用含a的表达式表示,下同)。 达到平衡时,C在反应混合气中体积分数是______(3分)
(2)在相同实验条件下,若在同一容器中改为2molA和6mol B,达到平衡后,C的物质的量为__________mol(3分)此时C在反应混合气体中的物质的量浓度______(填“增大”“减小”或“不变”)。(3分)
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中体积分数不变,则还应加入C_____mol。(2分)
26.(15分)下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物或反应物、反应条件均已略去。已知:A是一种常见固体单质;B、X都是气体,分属短周期中不同周期元素的单质;D是双原子分子,一个D分子中含有18个电子;化合物Y进行焰色反应时呈黄色。

(1) 写出D 的化学式_________;(2分)Y的电子式___________。(2分)
(2) A、B、X必定是由金属元素组成的为______;(2分)
(3)据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%-20%。A发生腐蚀的主要原因是(填写下面的选项序号)______________________;(2分)
a.化学腐蚀 b.电化学腐蚀 c.其它原因而腐蚀
(4)检验E中阳离子的实验方法有多种,请选择一种方法,你所选的试剂是________(2分)对应的现象是________________________________。(2分)
(5)写出沉淀J转化为沉淀H的化学反应方程式 __________________________。(3分)
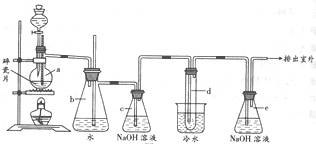
25. (14分)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
(14分)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
(1) 写出a、d装置中的两个化学反应方程式。__________________________(3分)
__________________________(3分)
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象______________________________________________________(3分)。
(3)容器c中NaOH溶液的作用是_____________________________________(3分)。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因是_______________________________________________________________________。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com